Introduction: Migreeniklinikka
Migreeni koostuu yksipuolisesta päänsärystä, johon liittyy joukko muita sensorisia, autonomisia ja kognitiivisia oireita, ja se on todettu Global burden of disease (GBD) -tutkimuksessa 2016 kuudenneksi yleisimmäksi häiriöksi ja yhdeksi tärkeimmistä työkyvyttömyyden syistä kaikkialla maailmassa, ja sitä esiintyy usein työikäisillä ja nuorilla aikuisilla ja keski-ikäisillä naisilla (Collaborators, 2018). Näin ollen migreeni edustaa erittäin vakavaa sosiaalista ongelmaa vammaisena elettyjen elinvuosien (YLD) osalta ja on tärkein YLD:n aiheuttaja 15-49-vuotiailla (ks. Steiner ym., 2018). Tällaisen sairauden aiheuttamaa taakkaa ei ole tunnistettu viime aikoihin asti, koska: migreeni ei aiheuta pysyvää työkyvyttömyyttä tai kuolemaa; päänsärkyä esiintyy satunnaisesti yleisväestössä (Collaborators, 2018). Vaikka migreenin lopullista patogeneesiä ei tunneta, kallonsisäinen verenkierto on osallisena (Drummond ja Lance, 1983). Migreenin kliininen kulku niveltyy eri seuraaviin tai samanaikaisiin vaiheisiin: premonitoriavaihe, aura, päänsärky ja postdrome (samanlainen kuin premonitoriavaihe) (Goadsby ym., 2017a). Premonitoriovaiheeseen kuuluu ärtyneisyys, ruoan himo, niskan jäykkyys, ja se voi esiintyä 2-72 tuntia ennen kohtausta ja jatkuu muiden vaiheiden yli. Kansainvälisen päänsärkyhäiriöluokituksen kolmannen painoksen (ICHD-3) määritelmien mukaan:
– auralle on ominaista yksi tai useampi ohimenevä, palautuva neurologinen vajaatoiminta, joista ainakin yhdellä on oltava yksipuolinen lokalisaatio, jotka kehittyvät vähintään 5 minuutin aikana ja joista kukin vajaatoiminta kestää 5-60 minuuttia;
– migreeni muodostuu 4-72 tuntia kestävistä päänsärkykohtauksista, joihin liittyy pahoinvointia, valo- ja fonofobiaa tai molempia (ks. Goadsby ym., 2017a).
Kutaanista allodyniaa, joka määritellään kivun havaitsemiseksi kivuttomien ärsykkeiden jälkeen, esiintyy yli 70 prosentilla potilaista (Lambru ym., 2018). Vaikea päänsärky vaimenee tai loppuu postdrooman vaiheessa, kun taas muut oireet, kuten astenia, somnolenssi ja fotofobia, vaikuttavat potilaaseen edelleen, mikä osoittaa migreenin taustalla olevan monimutkaisen neuraalisen perustan (Lambru et al., 2018). Sen mukaan, kuinka monta päivää kuukaudessa migreeni vaikuttaa, migreeni luokitellaan episodiseksi (alle 15 migreeni- tai päänsärkypäivää) tai krooniseksi (vähintään 15 päivää, joista vähintään 8 on migreenipäiviä) (ks. Goadsby ym., 2017b). Tämä näkökohta vaikuttaa huomattavasti sairauden vaikutuksiin ja hoitovaihtoehtoihin (Giamberardino ym., 2017). Kun kohtauksia on 1-3 kuukaudessa, on mahdollista käyttää vain abortoivia oireenmukaisia lääkkeitä, kun taas jos kohtauksia on 4-14 kuukaudessa, on pakko lisätä ennaltaehkäiseviä hoitoja; jälkimmäisiä hoitoja tarvitaan, jotta vältetään taudin kroonistuminen (Giamberardino ja Martelletti, 2015; Giamberardino ym, 2017) ja vähentämään lääkkeiden liikakäytön aiheuttaman päänsäryn ja refraktorisen migreenin riskiä (Martelletti, 2017).
Migreenin patofysiologia ja kalsitoniinigeeniin liittyvä peptidi (CGRP)
Migreenikohtausten tarkkaa syytä ei vielä tunneta, mutta nykyisessä tutkimuksessa on korostettu herkistymisprosessien merkitystä trigeminovaskulaarisessa järjestelmässä ja koko aivorungossa sekä havaittu vähentynyttä harmaata ainetta kipua prosessoivilla alueilla (ks. Goadsby ym, 2017a). Solurungon sisältävästä trigeminusganglionista pseudo-unipolaariset primaariset afferentit synapsoivat verisuoniin ja trigeminokervikaaliseen kompleksiin, josta lähtevät toisen asteen kuidut synapsoivat kolmannen asteen talamokortikaalisiin neuroneihin ja locus coeruleukseen, periaqueductal greyyn ja hypotalamukseen (Goadsby ym., 2017a). Trigeminaaliganglionista ja kaularanglion dorsaalijuuriganglioista lähtevät nociceptiviset kuidut innervoivat kovakalvon verisuonia, ja niiden päätepisteet vapauttavat vasoaktiivisia neuropeptidejä, kuten kalsitoniinigeeniin liittyvää peptidiä (CGRP), aiheuttaen verisuonten laajentumista. CGRP:n, CLR:n ja RAMP1:n ilmentyminen ihmisen kovakalvon verisuonissa on esitetty kuvissa 1A-C. Aivojen ulkopuolisia verisuonia hermottavat autonomiset hermosäikeet sisältävät useita välittäjäaineita sisältäviä vasoaktiivisia molekyylejä: noradrenaliinia, serotoniinia, asetyylikoliinia, neuropeptidi Y:tä (NPY), vasoaktiivista suolistopolypeptidiä (VIP), substanssi P:tä (SP), neurokiniini A:ta (NU) ja CGRP:tä (Goadsby ym., 1990). CGRP-reseptoriantagonistit vaikuttavat estämällä dura materista tulevan nociceptivisen informaation: se käsitellään talamuksen ytimissä, joista se saavuttaa korkeampia kortikaalisia alueita. Näitä trigeminovaskulaarisesta järjestelmästä tulevia signaaleja moduloi aivorungon laskeva reitti: 5-hydroksitryptamiinin (5HT)1B/1D-reseptoriagonistien eli triptaanien ajatellaan vaikuttavan tämän järjestelmän kautta ja kumoavan tapahtuneen vasodilataation. Propranololia ja topiramaattia käytetään ennaltaehkäisevänä hoitona, mutta jälkimmäisiä lääkkeitä käytetään akuuttien migreenikohtausten yhteydessä. Suoraan 5HT1B/D-presynaptisiin reseptoreihin vaikuttavat triptaanit estävät verisuonia supistavan vaikutuksensa lisäksi erityisesti sellaisten välittäjäaineiden, kuten CGRP:n, vapautumista, jotka ovat osallisina nociceptiossa. Lisäksi sumatriptaanin on kokeellisesti osoitettu estävän transienttireseptoripotentiaalin vanilloidi 1:n (TRPV1) välittämää sisäänpäin suuntautuvaa virtaa kolmoishermon ganglioissa (Evans ym., 2012). CGRP:tä vapautuu migreenikohtausten aikana, ja sillä on useita rooleja vasoaktiivisimpana neuropeptidinä, jonka kraniovaskulaariset tasot nousevat häiriön edetessä (Goadsby ym., 1990). CGRP:n on osoitettu muuttuvan myös aivo-selkäydinnesteessä (van Dongen ym., 2017). Muuttuneen sentraalisen eksitabiliteetin laukaisevia tekijöitä ja migreenikipuepisodien sitä seuraavaa läpimurtoa on tutkittu pitkään. Hermosäikeiden stimulaatio voi edistää sekä ortodromisia että antidromisia toimintapotentiaaleja, ja erityisesti transienttista reseptoripotentiaalia (TRP) ilmentävien duraalisten peptidergisten primaaristen sensoristen afferenttien aktivoituminen voi saada aikaan useiden molekyylien, kuten CGRP:n, vapautumisen, jotka laukaisevat tulehduksellisia kudosreaktioita, jotka tunnetaan nimellä ”neurogeeninen tulehdus” (Xanthos ja Sandkuhler, 2014). Erityisesti CGRP on osallisena kraniaalisessa nociceptionissa ja epifenomenona vasodilataatiossa, joka sitoo reseptoreitaan meningeaalisiin ja aivojen verisuoniin (Deen ym., 2017). Nämä prosessit edistävät kolmoishermon toisen asteen kuitujen herkistymistä, jotka vievät vahvistettuja kivuliaita ärsykkeitä korkeammille alueille, kuten talamukseen, hypotalamukseen ja aivokuoreen, ja näin syntyy migreeni (Dussor et al., 2014). TRP:t altistuvat aktivoitumiselle vasteena useille ympäristön ärsyttäville ärsykkeille, kuten lämpötilan ja pH:n vaihteluille, jotka alttiilla henkilöillä voivat laukaista migreenikivun. CGRP:tä tuotetaan kromosomissa 11 sijaitsevan kalsitoniinigeenin CALC I, joka koodaa myös kalsitoniinia, kudosspesifisellä vaihtoehtoisella liitoksella. Sitä vastoin β CGRP:tä tuotetaan CALC II -geenistä, joka sijaitsee eri kohdassa kromosomia 11. α CGRP -neuropeptidi esiintyy keskushermostossa 37 aminohapon α-isoformina, ja sen signaalinsiirtoa välittävät kaksi reseptoria.
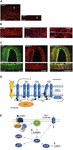
KUVIO 1. CGRP-geeni. CGRP:n esiintyminen ja reitti migreenissä. CGRP:n, CLR:n ja RAMP1:n ilmentyminen ihmisen kovakalvon verisuonissa: (A) CGRP-immunoreaktiivisuus esiintyy adventitian ohuissa kuiduissa; (B) poikki- ja pitkittäisleikkaukset, joissa näkyy RAMP1-ekspressio sileälihassolujen sytoplasmassa; (C) CLR:n ja RAMP1:n yhteisekspressio sileälihassolukerroksessa. (D) CGRP-reseptorin komponentit ja reseptorin signaloinnin ja internalisaation kannalta tärkeät jäännökset. CGRP-reseptorin muodostavat CLR (sininen), RAMP1 (keltainen) ja RCP (oranssi). Toiminnallisesti tärkeät jäännökset on esitetty yksikirjaimisina lyhenteinä. Aminohappojäännökset on numeroitu ennustetun N-terminaalisen signaalipeptidin (Swiss-Prot Q16602) alusta alkaen. Useat CLR:n C-terminaalissa olevat aminohapot (∼N400-C436) ja I312 ICL3:n/TM5:n liitoskohdassa ovat välttämättömiä tehokkaalle CGRP:n välittämälle internalisaatiolle. CGRP-reseptorin tärkeät piirteet, mukaan lukien TM6:n ”kinkki” (P343) ja CLR:n oletettu kahdeksas kierre (∼G388-W399), on havainnollistettu. C′, C-terminaali; ECL, solunulkoinen silmukka; ICL, solunsisäinen silmukka; N′, N-terminaali; TM, transmembraani. (E) CGRP-reseptorin välittämä solunsisäinen signalointi: Gαs-signalointi lisää AC:n (vihreä) aktiivisuutta, mikä nostaa solunsisäistä cAMP:ia, aktivoi PKA:ta ja sen jälkeen monia mahdollisia myötävirtaan vaikuttavia tekijöitä. Paneelit (A-C) on mukailtu Eftekhari ym. (2013) ja paneelit (D,E) Walker ym. (2010) luvalla.
Ensimmäinen tunnetaan kanonisena CGRP-reseptorina, ja se on Gαs-proteiiniin kytkeytynyt reseptori, joka vaatii reseptoriaktiivisuutta muokkaavan proteiinin (RAMP) 1 ollakseen toiminnallinen (Goadsby ym., 2017a). Toinen on ihmisen amyliinin alatyypin 1 reseptori (AMY1): amyliini kuuluu kalsitoniinigeeniperheeseen ja sillä on hormonaalista toimintaa. Kun CGRP sitoutuu reseptoriinsa, se altistuu dynamiinista/klatriinista riippuvaiselle internalisaatiolle sen jälkeen, kun se on kompleksoitunut β-arrestiinin kanssa (ks. Walker ym., 2010). Konformaatiomuutokset aiheuttavat adenylaattisyklaasin (AC) aktivoitumisen, cAMP:n lisääntymisen ja proteiinikinaasi A:n (PKA) aktivoitumisen, mikä voi edistää vasodilataatiota endoteelin typpioksidisyntaasin suoran aktivoitumisen ja kipuvasteiden kautta. Jälkimmäinen reseptori voi kytkeytyä Gαq/11:een fosfolipaasi C:n (PLC) aktivoitumisen myötä, mitogeeniaktivoituun proteiinikinaasiin (MAPK) ja NO:n vapautumiseen (ks. Walker ym., 2010) (ks. kuvat 1D, E, joissa on kaavamainen esitys CGRP-reseptorin välittämästä solunsisäisestä signaloinnista). CGRP:n antaminen migreeniä sairastaville laukaisee kohtauksia, ja tämä näyttö tukee sen keskeistä roolia migreenin patogeneesissä (Lassen ym., 2002). Signaalin lopetusjärjestelmää ei ole vielä tunnistettu: CGRP metaboloituu neprilysiinin, insuliinia hajottavan entsyymin ja endoteliinia konvertoivan entsyymi-1:n avulla, ja on esitetty hypoteesi takaisinoton aktiivisesta kuljetusjärjestelmästä (ks. Russell ym., 2014). Lisäksi kun reseptori aktivoituu ohimenevästi CGRP:llä, se sisäistetään endosomeihin ja kierrätetään nopeasti takaisin solukalvolle, kun taas reseptorin krooninen stimulaatio indusoi desensitisaation ja lysosomaalisen hajoamisen (ks. Russell ym, 2014).
Farmakologiset interventiot CGRP-reitillä
Migreeni on monimuotoinen invalidisoiva neurovaskulaarinen häiriö, ja nykyinen hoito suun kautta otettavilla triptaaneilla on tehokasta akuuteissa kohtauksissa, joskin noin 40 % potilaista on resistenttejä hoidolle (Ferrari ym., 2001; Edvinsson, 2015). Nämä selektiiviset 5-HT1B/1D-agonistit, joista yleisimmin käytetty on sumatriptaani, joka on useimmiten aktiivinen ihon alle annosteltavaksi, harjoittavat terapeuttista vaikutustaan kallonsisäisten verisuonten vasokonstriktion ja kolmoishermo- ja trigeminokervikaalijärjestelmän eston kautta (ks. Ferrari ym., 2001). Vasokonstriktio kuitenkin rajoittaa näiden lääkkeiden kardiovaskulaarisia sivuvaikutuksia. Lisäksi triptanihoito ei voi kestää yli 9 päivää kuukaudessa lääkkeen aiheuttaman päänsäryn riskin vuoksi. Vuonna 2010 Food and Drug Administration (FDA) hyväksyi A-tyypin botuliinitoksiinin (BoNT-A) migreenin ehkäisyyn kroonisille migreenikroonikoille, jotka eivät reagoi migreeniin, mutta sen monimutkainen antotapa (se vaatii injektion 31 kohtaan) rajoittaa potilaiden sitoutumista. Koska CGRP:llä on keskeinen rooli migreenin patofysiologiassa, sen reseptorin antagonisteja on kehitetty. Nämä lääkkeet kuuluvat gepanttien luokkaan. Telgecepantti, ensimmäinen suun kautta otettava gepantti, osoittautui hyvin siedetyksi sepelvaltimotaudista kärsivillä migreenipotilailla (ClinicalTrials.gov NCT00662818, Ho et al., 2012), mutta sillä oli hepatotoksisuutta, joten näiden pienten molekyylien jatkuvasta tutkimuksesta huolimatta ehdotettiin uutta lähestymistapaa, jossa kehitettiin monoklonaalisia vasta-aineita (mAb:it) CGRP:tä (nezumabit) tai CGRP-reseptoria (numabit) vastaan. Näiden lääkkeiden uskotaan estävän kiertävien CGRP-molekyylien vaikutusta migreenikohtausten ehkäisemiseksi, ja koska ne eivät kokonsa vuoksi läpäise veri-aivoestettä (BBB), niiden vaikutuskohtien pitäisi olla kolmoishermojärjestelmässä (Edvinsson, 2015). Erityisesti duraaliset verisuonet eivät kuulu BBB:hen. Lisäksi CGRP ei todennäköisesti ylitä BBB:tä ja toimii parakriinisena modulaattorina, koska sitä ilmentävät puolet kolmoishermopunoksen ganglionien neuroneista, jotka eivät esitä CGRP-reseptoria, jota ilmentävät satelliittiset gliasolut ja 30 prosenttia kolmoishermopunoksen ganglionien neuronisomasta (ks. Yuan et ai., 2017). Tällä hetkellä kliinisissä tutkimuksissa episodisen ja kroonisen migreenin hoitoon tutkitaan neljää mAb:tä, eptinezumabia, fremanezumabia, galcanezumabia ja erenumabia. Kolme ensimmäistä mAb:tä ovat humanisoituja vasta-aineita, jotka kohdistuvat CGRP:hen, kun taas erenumabi on ihmisen vasta-aine sen kanonista reseptoria vastaan. Näiden lääkkeiden puoliintumisaika on melko pitkä, joten niitä voidaan antaa vain kerran kuukaudessa, mikä on kiinnostavaa, koska mAb:t on annettava laskimoon tai ihon alle. Erityisesti eptinezumabia annetaan vain laskimoon (Israel ym., 2018). Vaiheen III PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) -tutkimuksessa (ClinicalTrials.gov NCT02559895) arvioitiin eptinezumabin tehoa usein toistuvan episodisen migreenin ehkäisyssä. Tulokset osoittivat, että ensisijainen päätetapahtuma, joka koostui kuukausittaisten migreenipäivien (MMD) vähenemisestä keskimääräisestä lähtötilanteen 8,5 päivästä viikkojen 1-12 aikana, väheni merkittävästi 4,3 MMD:hen 300 mg:n annoksella, 3,9:ään 100 mg:n annoksella ja 4,0:aan 30 mg:n annoksella suhteessa lumelääkkeen 3,2 päivään (Saper ym., 2018). Kroonisen migreenin ennaltaehkäisyssä käytettävän eptineitsumabin arviointia varten PROMISE 2 -tutkimukseen (ClinicalTrials.gov NCT02974153) on otettu 1121 osallistujaa. Galcanezumabin tehoa episodisen migreenin ehkäisyssä arvioitiin EVOLVE-1-vaiheen 3 kaksoissokkoutetussa, satunnaistetussa, lumekontrolloidussa tutkimuksessa (ClinicalTrials.gov NCT02614183), joka oli pilkottu neljään jaksoon, ja EVOLVE-2-vaiheen 3 satunnaistetussa, kontrolloidussa ja satunnaistetussa, kaksoissokkoutetussa, 6 kuukautta kestäneessä kliinisessä tutkimuksessa (ClinicalTrials.gov NCT02614196). EVOLVE-1-tutkimuksessa molemmat galcanezumabiannokset (120 ja 240 mg) täyttivät ensisijaisen päätetapahtuman, joka oli kuukausittaisten migreenipäänsärkypäivien merkittävä väheneminen 4,7 päivällä ja 4,6 päivällä verrattuna lumelääkkeen 2,8 päivään (Stauffer ym., 2018). EVOLVE-2-tutkimuksessa potilaat saivat kuukausittain 120 tai 240 mg:n galcanezumabi-injektion. Keskimääräiset kuukausittaiset migreenipäänsärkypäivät vähenivät vastaavasti 4,3 ja 4,2 päivää verrattuna lumelääkkeellä saatuun 2,3 päivän vähenemiseen (p < 0,001) (Skljarevski ym., 2018). Myös toissijaiset päätetapahtumat, jotka olivat migreenikohtaisen elämänlaatukyselylomakkeen (MSQ) Role Function-Restrictive (R-FR) -alueen pistemäärän avulla arvioitujen toimintakyvyn heikkenemisen väheneminen sekä PGI-S (Patient Global Impression of Severity) ja MIDAS (Migraine Disability Assessment; aikapiste = 6. kuukausi) -pistemäärien paraneminen, täyttyivät (Skljarevski ym., 2018). 147 (65,0 %) ja 163 (71,5 %) galkaanitsumabilla 120 mg ja 240 mg hoidetuista potilaista ja 287 (62,3 %) lumelääkkeellä hoidetuista potilaista sairasti haittatapahtumia, joista akuutti sydäninfarkti ja ohimenevä iskeeminen kohtaus seitsemän potilaan ryhmässä, jota hoidettiin galkaanitsumabilla 240 mg (Skljarevski ym., 2018). Systolisen/diastolisen verenpaineen keskimääräisessä muutoksessa lähtötilanteesta ei ollut tilastollisesti merkitseviä eroja. Vastaavasti 19:llä (8,6 %), 11:llä (5,1 %) ja 2:lla (0,5 %) potilaalla galkaanitsumabi 120 mg:n, galkaanitsumabi 240 mg:n ja lumelääkeryhmässä ilmeni hoidon yhteydessä ilmeneviä vasta-aineita (ADA). REGAIN-vaiheen III tutkimuksessa, jossa arvioitiin galkaanitsumabia kroonisen migreenin hoidossa, MMD:t lyhenivät 120 mg:n annoksella 4,8 vuorokautta ja 240 mg:n annoksella 4,6 vuorokautta verrattuna lumelääkkeen 2,7 vuorokauteen (ks. Yuan ym., 2017). Lisäksi galcanezumabihoidolla osoitettiin olevan tilastollisesti merkittävä vaikutuksen pysyvyys (Forderreuther ym., 2018). Fremanetsumabia tutkittiin vaiheen III HALO-tutkimuksessa migreenin ennaltaehkäisevää hoitoa varten (ClinicalTrials.gov NCT02638103). Se vähensi episodisen migreenin MMD:tä 12 viikon kohdalla 3,7 päivää 225 mg:n kuukausittaisella annoksella 3 kuukauden ajan ja 3,4 päivää 675 mg:n annoksella kerran neljännesvuosittain annosteltavalla annosteluohjelmalla verrattuna lumelääkkeen 2,2 päivän vähenemiseen (ks. Yuan ym., 2017). Erenumabin tehoa episodisen migreenin ehkäisyssä tutkittiin vaiheen 3 satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa ARISE-tutkimuksessa (ClinicalTrials.gov NCT02483585). MMD:t vähenivät 70 mg:n kuukausittaisella ihonalaisella 70 mg:n erenumabilla 2,9 päivää lumelääkkeen 1,8 päivään verrattuna (p < 0,001), ja se oli tehokas toissijaisissa päätetapahtumissa, jotka olivat MMD:iden väheneminen vähintään 50 %:lla ja kuukausittaisten migreenikohtaisten lääkehoitopäivien (MSMD) muuttuminen (Dodick ym., 2018). Haittavaikutuksia esiintyneiden potilaiden osuus oli samankaltainen mAb:llä ja lumelääkkeellä hoidetun ryhmän välillä. 4,3 %:lla testattiin positiivisesti anti-erenumabia sitovia vasta-aineita viikolla 12, ja yksi heistä oli ohimenevästi positiivinen neutraloivien vasta-aineiden suhteen, mutta vasta viikolla 4 (Dodick ym., 2018). Myös vaiheen III kliinisessä STRIVE-tutkimuksessa (ClinicalTrials.gov NCT02456740) arvioitiin erenumabin tehokkuutta episodisen migreenin ehkäisyssä. Erenumabia annettiin 70 tai 140 mg kuukausittain 6 kuukauden ajan (Goadsby ym., 2017b). Lähtötilanteen keskimääräinen MMD-päivien määrä oli 8,3, ja 70 mg:n ja 140 mg:n annokset vähensivät sitä 3,2 ja 3,7 päivää lumelääkkeeseen verrattuna (p < 0,001 kummallakin annoksella verrattuna lumelääkkeeseen) (Goadsby ym., 2017b). Myös kolmen viimeisen hoitokuukauden aikana kukin erenumabiannos täytti toissijaiset päätetapahtumat, jotka olivat vähintään 50 %:n vähennys lähtötilanteesta migreenipäivien keskimääräisessä määrässä kuukaudessa ja vähennys lähtötilanteesta sekä migreenin fyysisen toimintakyvyn vaikutusten päiväkirjan (MPFID) arkipäiväisen toiminnan (MPFID-EA) että fyysisen toimintakyvyn heikkenemisen (MPFID-PI) mittauksissa (Goadsby ym., 2017b). Niistä potilaista, joilla oli anti-erenumabivasta-aineita, vain yhdellä 70 mg:lla hoidetussa ryhmässä testattiin positiivisia neutraloivia vasta-aineita, ja mAb oli kaiken kaikkiaan hyvin siedetty kreatiniiniarvojen, maksatoksisuuden, neutrofiilien kokonaismäärän ja elektrokardiografisen toiminnan suhteen (Goadsby ym., 2017b). Kirjoittajien mukaan yksi tämän tutkimuksen rajoituksista on se, että tutkimuksesta suljettiin pois potilaat, joilla ei ollut todettu terapeuttista vastetta useammalle kuin kahdelle migreeniä ehkäisevälle lääkeryhmälle (Goadsby ym., 2017b). Lisäksi on olemassa kliinisiä tutkimuksia, joissa tutkitaan fremanetsumabin (NCT02945046 ja NCT02964338) ja galcanetsumabin (NCT 02397473 ja NCT02438826) tehoa klusteripäänsäryn ennaltaehkäisyssä (ks. Israel ym., 2018), eli primaarisessa päänsäryssä, jolle on ominaista voimakas yksipuolinen kipu silmänympärysalueen alueella ja johon liittyy kyynelehtimistä, silmän sidekalvojen punoitusta ja nuhaa (Vollesen ym., 2018). Todellakin osoitettiin, että 1,5 μg/min CGRP:n jatkuva laskimonsisäinen infuusio infuusiopumpun kautta 20 minuutin ajan (kahtena päivänä, joiden välillä on vähintään 7 päivää) potilailla, joilla on episodinen (aktiivinen tai remissiovaihe) tai krooninen klusteripäänsärky, sai aikaan klusteripäänsäryn kaltaisia kohtauksia potilailla, joilla oli aktiivinen vaihe tai krooninen klusteripäänsärky, mutta ei remissiovaiheessa (ClinicalTrials.gov NCT02466334) (Vollesen ym., 2018). mAbien tärkeimpiä PK-etuja edustavat pitkä eliminaation puoliintumisaika, mikä rajoittaa päivittäisen annostelun tarvetta, ja puhdistuma proteolyysin avulla. Gepanttien maksavaikutusten ja CGRP:n vasodilatoivien ominaisuuksien vuoksi CGRP-signaloinnin eston pelätyimmät riskit koostuvat hypoteesin mukaisesta hepatotoksisuudesta ja kardiovaskulaarisesta teoreettisesta riskistä (Yuan ym., 2017). Euroopan päänsärkyliitto (EHF) on laatinut ohjeet CGRP-vastaisten mAbien käytöstä soveltaen GRADE-menetelmää (Grading of Recommendation, Assessment, Development and Evaluation) ja tukeutuen asiantuntijapaneelin mielipiteeseen silloin, kun se ei ole mahdollista (Sacco ym., 2019).
Migreenin vastaisten mAbien farmakokinetiikan (PK) ja farmakodynamiikan (PD) suhde
Migreenin vastaisten mAbien kehittäminen on edustanut täysin uutta lähestymistapaa CGRP-reitin estämiseen. Tärkein PD-parannus, joka saavutetaan käyttämällä mAb:itä pienten molekyylien sijaan, on se, että on helpompi kohdistaa laajaan CGRP-reseptori-ligandin sitoutumiskohtaan (Taylor, 2018). mAbien tärkeimpiä PK-etuja edustavat pitkä eliminaation puoliintumisaika ilman tarvetta päivittäiseen annosteluun ja puhdistuma proteolyysin avulla, ja CGRP-signalisaation estämisen pelätyimmät riskit koostuvat hypoteesin mukaisesta maksatoksisuudesta, joka johtuu gepanttien vaikutuksista maksaan, ja kardiovaskulaarisesta teoreettisesta riskistä, joka johtuu CGRP:n vasodilatoivista ominaisuuksista. Näiden mAbien matkalla niiden tuotannosta kohteeseen ensimmäinen este, jonka nämä molekyylit kohtaavat, on kuitenkin niiden antaminen, koska niiden oraalinen biologinen hyötyosuus on vähäinen. Siksi tarvitaan parenteraalista antoreittiä, ja hoitoon sitoutumisen edistämiseksi puoliintumisajan on oltava pitkä (Taylor, 2018). Immunoglobuliinit (Ig)G1, 2 tai 4 ovat mahdollisia (Wang ym., 2008; Taylor, 2018). IgG:n alkuperän lisäksi mahdollinen ristireaktiivisuus ja katabolian yksilölliset modifikaatiot voivat vaikuttaa puoliintumisaikaan (Bonilla, 2008; Taylor, 2018). mAb:iden tuottamiseen käytetty teknologia perustuu jatkuvassa jakautumisessa olevista soluista koostuvien hybridoomien käyttöön, jotka tuottavat yhden vasta-ainetyypin määrätietoisia klooneja, joissa ei ole lainkaan tai vain vähän vaihtelua (Taylor, 2018). mAb:n muodostavien aminohappojen alkuperän perusteella voidaan erottaa toisistaan kimeeriset (jyrsijän immunisointi; jyrsijän Fragmentin antigeeniä sitovan alueen Fab säilyttäminen, mutta ihmisen Fragmentin kiteytyvän alueen Fc lisääminen), humanisoidut (zumabit, joissa hiiren Komplementaarisuutta määrittävät alueet, CDR:t, on siirretty ihmisen Fab-alueisiin) ja inhimilliset (ihmisen vasta-ainegeenin koko sekvenssin lisääminen hiireen, joka muuttuu inhimillistetyksi, kuten esimerkiksi XenoMouse -hiiriyksilö) mAb:t) musvasta-aineet (katso Taylor, 2018). CDR:t vaikuttavat sopeutumiseen kohteeseen. Neljästä migreenin vastaisesta mAb:stä vain erenumabi on ihmisestä, kun taas fremanetsumabin osalta siirretyt CDR:t ovat hiirestä, eptinezumabin osalta kanista ja galcanetsumabin osalta todennäköisesti hiirestä (ks. Taylor, 2018). Erityisesti ainoa CGRP-reseptorin vastainen mAb on erenumabi, joka on ihmisen IgG2λ, ja kolme muuta CGRP-kohtiin suunnattua mAbia ovat: eptinezumabi, geneettisesti muokattu humanisoitu IgG1k; fremanezumabi, humanisoitu IgG2k; galcanezumabi, humanisoitu IgG4 (Edvinsson ym., 2018). Erenumabi (Tmax 3-14 vrk) edellyttää kuukausittaista ihonalaista antoa, samoin fremanetsumabi (Tmax 3-20 vrk) ja galkaanetsumabi (Tmax 7-14 vrk) (Taylor, 2018). Sitä vastoin eptineitsumabi (Tmax 4,8 h) annetaan laskimoon kerran 3 kuukauden välein; se assosioituu nopeammin ja dissosioituu hitaammin kuin fremanetsumabi ja galkaanitsumabi. Koska mAb:t ovat suurikokoisia proteiineja, ne eivät pääse helposti BBB:n läpi. Jotkin CGRP-reseptorit ovat BBB:n ulkopuolella, mikä mahdollistaa anti-CGRP mAbien vaikutuksen (Edvinsson, 2018). Ennen sitoutumista vasta-aine pääsee verisuonten endoteelisoluihin pinosytoosin kautta. Suuret näennäiset jakautumistilavuudet voivat riippua kudoksesta ja siihen liittyvästä mAb:n sitoutumiskyvystä (Lobo ym., 2004; Taylor, 2018). Erenumabi on uusin lähestymistapa, sillä se on ainoa, joka kohdistuu ihmisen G-proteiinikytkentäisen reseptorin kalsitoniinireseptorin kaltaisen reseptorin CALCRL (jota tarvitaan CGRP:n ja adrenomedulliinin reseptoreissa) ja RAMP1:n solunulkoisten domeenien fuusioproteiiniin, mukaan lukien CGRP:n sitoutumistasku (Edvinsson ym., 2018). Sen on osoitettu estävän kilpailukykyisesti -CGRP:n sitoutumista ihmisen CGRP-reseptoriin ihmisen neuroblastoomasoluissa (SK-N-MC) Ki:n ollessa 0,02 ± 0,01 nM (Shi ym., 2016). Erenumabi harjoitti voimakasta ja täydellistä CGRP:n stimuloiman cAMP-kertymän antagonismia IC50-arvon ollessa 2,3 ± 0,9 nM SK-N-MC:ssä suoritetuissa toiminnallisissa määrityksissä (Shi ym., 2016). Lisäksi se johti 5000-kertaisesti selektiivisempään CGRP-reseptoriin, joka ei osoittanut agonisti-/antagonistivaikutusta muihin ihmisen kalsitoniiniperheen reseptoreihin, mukaan lukien adrenomedulliini-, kalsitoniini- ja amyliinireseptorit, korkeimpaan testattuun 10 μM:n pitoisuuteen asti (Shi et al., 2016). Fremanetsumabi saattaa vaikuttaa eri verisuonissa; itse asiassa se aiheuttaa pitoisuusriippuvaisen CGRP:n indusoiman vasodilataation eston ihmisen esikontraktoituneissa aivo-, aivokalvo- ja perifeerisissä vatsavaltimoissa (Ohlsson ym., 2018). Lisäksi CGRP voi vaikuttaa myös neuroneihin ja gliasoluihin sekä glymfaattisiin (lymfaattisiin) soluihin, joista jälkimmäinen on osallisena auran ilmenemisessä (ks. Messlinger, 2018). Maksan entsyymien aiheuttaman metabolian todennäköinen puuttuminen voisi välttää lääkkeiden välisiä yhteisvaikutuksia. Eliminaatio tapahtuu aminohappojen munuaisproteolyysin kautta. Vaikka kliinisissä tutkimuksissa raportoidaan, että nämä vasta-aineet ovat yleisesti ottaen hyvin siedettyjä, korostunutta pistoskohdan kipua lukuun ottamatta, niiden immunogeenisuudesta ADA:n tuottamisen kautta ollaan huolissaan (Taylor, 2018). Kaksoissokkoutetussa, satunnaistetussa, lumekontrolloidussa kliinisessä tutkimuksessa (ClinicalTrials.gov NCT 01337596), jossa arvioitiin hoitoa erilaisilla galcanezumabin kerta- ja moninkertaisilla annoksilla, 11:llä hoidetuista potilaista (26 %) esiintyi matalia (1:10 – 1:80) hoidon yhteydessä ilmeneviä ADA:n matalia tittereitä (kolmella potilaalla ennestään olemassa olevien vasta-aineiden titterit kasvoivat) ilman annosvastetta ja havaittuja vaikutuksia PK:hen ja PD:hen (Monteith ym., 2017). Immunogeenisuuden tutkiminen on olennaista, koska ADA:n läsnäolo voi nopeuttaa lääkkeen poistumista tai, mikä vielä pahempaa, edistää loppuelinvaurioita (Taylor, 2018). Migreeniä ehkäisevien mAbien tärkeimmät ominaisuudet on koottu taulukkoon 1.

Taulukko 1. Migreeniä ehkäisevien mAbien tärkeimmät ominaisuudet. Fremanetsumabin, eptinezumabin, galcanetsumabin ja erenumabin pääominaisuudet.
Johtopäätökset
Migreeni on invalidisoiva ja heikentävä neurovaskulaarinen kiputila, joka edustaa yli 90 %:a toistuvasta päänsärystä ja johon taipumus voi olla perinnöllinen (MacGregor, 2017). Divalproeksinatriumilla, natriumvalproaatilla, topiramaatilla, metoprololilla, propranololilla ja timololilla on todistetusti vahvaa, A-tason näyttöä migreenin ehkäisystä (American Academy of Neurology and American Headache Society, 2015). Kaikkia klassisia suun kautta otettavia ennaltaehkäiseviä hoitoja, kuten trisyklisiä masennuslääkkeitä, beetasalpaajia, 5-HT2-antagonisteja, ergotteja ja epilepsialääkkeitä, ei kuitenkaan ole kehitetty migreeniä varten, ja niiden avulla saadaan 50 %:n vähennys kuukausittaisten migreenikipupäivien määrässä vain 45 %:lla migreeniä sairastavista henkilöistä (D’Amico ja Tepper, 2008), mikä johtuu myös vähäisestä sitoutumisesta, joka johtuu niukasta siedettävyydestä. Lääkityksen pysyvyyttä ja lopettamista tutkittiin retrospektiivisessä yhdysvaltalaisessa korvausvaatimusten analyysissä (Hepp ym., 2017), ja tulokset viittaavat siihen, että alun perin käytetyn lääkkeen pysyvyys on vähäistä ja lopettamisen määrä on suuri kuuteen kuukauteen mennessä lääkeluokasta riippumatta. Koska CGRP:llä on perustavanlaatuinen rooli neuroinflammaation ja sentraalisen herkistymisen ylläpitämisessä reitillä kolmoishermosolmukkeesta ja aivorungosta korkeammille alueille, jotka osallistuvat migreenin fysiopatologiaan, on kehitetty uusia mAb:itä CGRP:tä ja sen reseptoria kohtaan. Ensimmäiset pienimolekyyliset CGRP-antagonistit osoittivat aiheuttavansa maksatoksisuutta, mutta mAb:t eivät tuottaneet myrkyllisiä metaboliitteja eivätkä kardiovaskulaarisia sivuvaikutuksia vasodilataation estämisen vuoksi (ks. Deen et al., 2017). Myöskään sentraalisia haittavaikutuksia ei tuotu esiin. CGRP:n eston mahdollisia pitkäaikaisvaikutuksia on vielä tutkittava, mutta näiden vasta-aineiden perustavanlaatuinen etu juontaa juurensa niiden pitkästä puoliintumisajasta, joka mahdollistaa kuukausittaiset tai harvemmin tapahtuvat injektiot, mikä voi merkittävästi parantaa hoitoon sitoutumista ja sen jälkeistä tehoa (Deen ym., 2017). Näin ollen anti-CGRP mAb:t voisivat olla tehokkaita välineitä terapeuttisessa arsenaalissa reagoimatonta migreeniä vastaan; tehon ja turvallisuuden (eli toksisten metaboliittien tuottaminen, immunogeenisuus ADA:n kanssa, neutraloivat vasta-aineet ja kudosten ristireaktiivisuus ja sivuvaikutukset) syvä seuranta on kuitenkin pakollista (Taylor, 2018). Itse asiassa vanhemmista bioteknisistä tuotteista saadut todisteet osoittavat, että kasvainnaekroositekijä α:n (TNFα) vasta-aineita sisältävillä mAb-valmisteilla toteutetuissa terapioissa voi esiintyä alkuperäisen terapeuttisen vasteen sekundaarista epäonnistumista (toisin kuin primaarisessa vastaamattomuudessa), koska nämä lääkkeet indusoivat sellaisten vasta-aineiden tuotantoa, jotka voivat hajottaa mAb-valmistetta, mutta ne voivat myös neutralisoida sen vaikutuksen, ennen kuin se ehtii sitoutua kohdehenkilöönsä (ks. Prado et al., 2017). Immunogeenisuuteen voivat vaikuttaa glykosylaatio, mAb:n tyyppi, epitooppien määrä ja epäpuhtaudet formulaatiossa (ks. Prado et al., 2017). Lisäksi useat ilmeisesti selittämättömät vakavat haittavaikutukset liittyvät anti-TNFα:n immunogeenisuuteen. Paikalliset ja systeemiset yliherkkyysreaktiot, immuunipuutos, johon liittyy lisääntynyt alttius infektioille, ja immuunikompleksin muodostuminen, joka voi johtaa jopa kuolemaan, on tuotu esiin (ks. Prado ym., 2017). Siksi terapeuttisen diagnostiikan (theranostiikka) käyttö voi parantaa näiden farmakologisten laitteiden tuntemusta ja oikeaa hallintaa (Bendtzen, 2013; Prado ym., 2017).
Tekijöiden kontribuutiot
MTC, LAM, PT ja GB ideoivat tutkimuksen. DS keräsi tutkimustulokset, analysoi kirjallisuutta ja kirjoitti käsikirjoituksen. AA, LR ja MN osallistuivat kirjallisuustutkimukseen. Kaikki kirjoittajat lukivat ja hyväksyivät lopullisen käsikirjoituksen.
Conflict of Interest Statement
Tekijät ilmoittavat, että tutkimus on tehty ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
American Academy of Neurology and American Headache Society (2015). Liite a: yhteenveto näyttöön perustuvasta ohjeesta kliinikoille, päivitys: farmakologinen hoito episodisen migreenin ehkäisemiseksi aikuisilla. Continuum 21, 1165-1166. doi: 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | CrossRef Full Text | Google Scholar
Bendtzen, K. (2013). Yksilöllistetty lääketiede: theranostiikka (terapeuttinen diagnostiikka) olennaista tuumorinekroositekijä-alfa-antagonistien rationaalisessa käytössä. Discov. Med. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). Suonensisäisesti tai ihonalaisesti annostellun immunoglobuliinin farmakokinetiikka. Immunol. Allergy Clin. North Am. 28, 803-819. doi: 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Collaborators, G. B. D. H. (2018). Migreenin ja jännitystyyppisen päänsäryn maailmanlaajuinen, alueellinen ja kansallinen taakka, 1990-2016: systemaattinen analyysi Global burden of disease study 2016 -tutkimusta varten. Lancet Neurol. 17, 954-976. doi: 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., and Tepper, S. J. (2008). Migreenin ennaltaehkäisy: yleiset periaatteet ja potilaiden hyväksyntä. Neuropsychiatr. Dis. Treat. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Rubio-Beltran, E., et al. (2017). CGRP:n estäminen migreenipotilailla – katsaus hyviin ja huonoihin puoliin. J. Headache Pain 18:96. doi: 10.1186/s10194-017-0807-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V., ym. mukaan (2018). ARISE: vaiheen 3 satunnaistettu tutkimus erenumabista episodisen migreenin hoidossa. Cephalalgia 38, 1026-1037. doi: 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D., ja Lance, J. W. (1983). Kallonsisäiset verisuonimuutokset ja kivun lähde migreenipäänsäryssä. Ann. Neurol. 13, 32-37. doi: 10.1002/ana.410130108
PubMed Abstract | CrossRef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J. Y., Ossipov, M. H., Dodick, D. W. ja Porreca, F. (2014). TRP-kanavien kohdistaminen uusiin migreeniterapioihin. ACS Chem. Neurosci. 5, 1085-1096. doi: 10.1021/cn500083e
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2015). CGRP-reseptoriantagonistit ja vasta-aineet CGRP:tä ja sen reseptoria vastaan migreenin hoidossa. Br. J. Clin. Pharmacol. 80, 193-199. doi: 10.1111/bcp.12618
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2018). CGRP-reitti migreenissä elinkelpoisena hoitokohteena. Headache 58(Suppl. 1), 33-47. doi: 10.1111/head.13305
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L., Haanes, K. A., Warfvinge, K. ja Krause, D. N. (2018). CGRP uusien migreenihoitojen kohteena – onnistunut translaatio penkistä klinikalle. Nat. Rev. Neurol. 14, 338-350. doi: 10.1038/s41582-018-0003-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Eftekhari, S., Warfvinge, K., Blixt, F. W., ja Edvinsson, L. (2013). CGRP:tä ja CGRP-reseptoreita varastoivien hermosäikeiden erilaistuminen perifeerisessä trigeminovaskulaarisessa järjestelmässä. J. Pain 14, 1289-1303. doi: 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, M. S., Cheng, X., Jeffry, J. A., Disney, K. E., ja Premkumar, L. S. (2012). Sumatriptaani estää TRPV1-kanavia kolmoishermosoluissa. Headache 52, 773-784. doi: 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B., ja Goadsby, P. J. (2001). Suun kautta otettavat triptaanit (serotoniinin 5-HT(1B/1D)-agonistit) akuutin migreenin hoidossa: 53 tutkimuksen meta-analyysi. Lancet 358, 1668-1675. doi: 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K. ja Lainez, M. J. A. (2018). Galcanezumabin ennaltaehkäisevät vaikutukset aikuispotilailla, joilla on episodinen tai krooninen migreeni, ovat pysyviä: tiedot vaiheen 3 satunnaistetuista, kaksoissokkoutetuista, lumekontrolloiduista EVOLVE-1-, EVOLVE-2- ja REGAIN-tutkimuksista. J. Headache Pain 19:121. doi: 10.1186/s10194-018-0951-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F. ja Martelletti, P. (2017). Kalsitoniinigeeniin liittyvä peptidireseptori uutena kohteena episodista migreeniä sairastavien hoidossa: nykyinen näyttö ja erenumabin turvallisuusprofiili. J. Pain Res. 10, 2751-2760. doi: 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., ja Martelletti, P. (2015). Kehittyvät lääkkeet migreenin hoitoon. Expert Opin. Emerg. Drugs 20, 137-147. doi: 10.1517/14728214.2015.999040
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Edvinsson, L. ja Ekman, R. (1990). Vasoaktiivisten peptidien vapautuminen ihmisen ekstraserebraalisessa verenkierrossa migreenipäänsäryn aikana. Ann. Neurol. 28, 183-187. doi: 10.1002/ana.410280213
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Holland, P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C. ja Akerman, S. (2017a). Migreenin patofysiologia: aistien käsittelyn häiriö. Physiol. Rev. 97, 553-622. doi: 10.1152/physrev.00034.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J. H., Zhang, F., et al. (2017b). Erenumabin kontrolloitu tutkimus episodisen migreenin hoidossa. N. Engl. J. Med. 377, 2123-2132. doi: 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P., et al. (2017). Suun kautta otettavien migreeniprofylaktisten lääkkeiden pysyvyys ja vaihtomallit kroonista migreeniä sairastavien potilaiden keskuudessa: retrospektiivinen korvausvaatimusten analyysi. Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J., et al. (2012). Satunnaistettu, kontrolloitu tutkimus telkagepantista potilailla, joilla on migreeni ja sepelvaltimotauti. Headache 52, 224-235. doi: 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L., and Reuter, U. (2018). CGRP-monoklonaaliset vasta-aineet migreenin ennaltaehkäisevässä hoidossa. Curr. Pain Headache Rep. 22:38. doi: 10.1007/s11916-018-0686-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M. ja Martelletti, P. (2018). Migreenin hoidossa käytettävät uudet lääkkeet: päivitys. Expert Opin. Emerg. Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B., ja Olesen, J. (2002). CGRP:llä voi olla syy-yhteys migreeniin. Cephalalgia 22, 54-61. doi: 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E. D., Hansen, R. J., ja Balthasar, J. P. (2004). Vasta-aineiden farmakokinetiikka ja farmakodynamiikka. J. Pharm. Sci. 93, 2645-2668. doi: 10.1002/jps.20178
PubMed Abstract | CrossRef Full Text | Google Scholar
MacGregor, E. A. (2017). Migreeni. Ann. Intern. Med. 166, ITC49-ITC64. doi: 10.7326/AITC20170404040
PubMed Abstract | CrossRef Full Text | Google Scholar
Martelletti, P. (2017). CGRP(r)-monoklonaalisten vasta-aineiden käyttö migreenin spektrissä: tarpeet ja prioriteetit. BioDrugs 31, 483-485. doi: 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). Suuri CGRP-tulva – lähteet, nielut ja signalointipaikat trigeminovaskulaarisessa järjestelmässä. J. Headache Pain 19:22. doi: 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., Vandermeulen, C., Van Hecken, A., Raddad, E., Scherer, J. C., et al. (2017). CGRP:tä sitovan monoklonaalisen vasta-aineen LY2951742 (galcanezumabi) turvallisuus, siedettävyys, farmakokinetiikka ja farmakodynamiikka terveillä vapaaehtoisilla. Front. Pharmacol. 8:740. doi: 10.3389/fphar.2017.00740
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J. ja Edvinsson, L. (2018). Fremanetsumabi estää CGRP:n aiheuttaman laajentuman ihmisen aivo-, keskimmäisen aivokalvon ja vatsan valtimoissa. J. Headache Pain 19:66. doi: 10.1186/s10194-018-0905-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Prado, M. S., Bendtzen, K., and Andrade, L. E. C. (2017). Biologiset anti-TNF-lääkkeet: hoidon epäonnistumisen ja haittavaikutusten taustalla oleva immunogeenisuus. Expert Opin. Drug Metab. Toxicol. 13, 985-995. doi: 10.1080/17425255.2017.1360280
PubMed Abstract | CrossRef Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X., ja Brain, S. D. (2014). Kalsitoniinigeeniin liittyvä peptidi: fysiologia ja patofysiologia. Physiol. Rev. 94, 1099-1142. doi: 10.1152/physrev.00034.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U., Terwindt, G., Mitsikostas, D. D., et al. (2019). Euroopan päänsärkyliiton ohje kalsitoniinigeeniin liittyvään peptidiin tai sen reseptoriin vaikuttavien monoklonaalisten vasta-aineiden käytöstä migreenin ehkäisyssä. J. Headache Pain 20:6. doi: 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., Dodick, D., Silberstein, S., ym. et al. (2018). PROMISE-1 (prevention of migraine via intravenous eptinezumab safety and efficacy-1) -tutkimuksen ensisijaiset tulokset: vaiheen 3 satunnaistettu, kaksoissokkoutettu, plasebokontrolloitu tutkimus, jossa arvioitiin eptinezumabin tehoa ja turvallisuutta usein toistuvan episodisen migreenin ehkäisyssä (S20.001). Neurology 90(15 Suppl.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al. (2016). AMG 334:n, voimakkaan ja selektiivisen ihmisen monoklonaalisen vasta-aineen farmakologinen karakterisointi kalsitoniinigeeniin liittyvää peptidireseptoria vastaan. J. Pharmacol. Exp. Ther. 356, 223-231. doi: 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K. ja Yang, J. Y. (2018). Galcanezumabin teho ja turvallisuus episodisen migreenin ehkäisyssä: EVOLVE-2 vaiheen 3 satunnaistetun kontrolloidun kliinisen tutkimuksen tulokset. Cephalalgia 38, 1442-1454. doi: 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J. ja Conley, R. R. (2018). Galcanezumabin arviointi episodisen migreenin ehkäisyssä: EVOLVE-1 satunnaistettu kliininen tutkimus. JAMA Neurol. 75, 1080-1088. doi: 10.1001/jamaneurol.2018.1212
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R., and Katsarava, Z. (2018). Migreeni on ensimmäinen työkyvyttömyyden syy alle 50-vuotiailla: huomaavatko terveyspoliitikot nyt? J. Headache Pain 19:17. doi: 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R. (2018). CGRP, amyliini, immunologia ja päänsärkylääketiede. Headache 59, 131-150. doi: 10.1111/head.13432
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al. (2017). Migreenin biomarkkerit aivo-selkäydinnesteessä: systemaattinen katsaus ja meta-analyysi. Cephalalgia 37, 49-63. doi: 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A. L. H., Snoer, A., Beske, R. P., Guo, S., Hoffmann, J., Jensen, R. H., et al. (2018). Kalsitoniinigeeniin liittyvän peptidin infuusion vaikutus klusteripäänsärkykohtauksiin: satunnaistettu kliininen tutkimus. JAMA Neurol. 75, 1187-1197. doi: 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, C. S., Conner, A. C., Poyner, D. R., and Hay, D. L. (2010). Kalsitoniinigeeniin liittyvien peptidireseptorien signaalinsiirron säätely. Trends Pharmacol. Sci. 31, 476-483. doi: 10.1016/j.tips.2010.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, E. Q. ja Balthasar, J. P. (2008). Monoklonaalisten vasta-aineiden farmakokinetiikka ja farmakodynamiikka. Clin. Pharmacol. Ther. 84, 548-558. doi: 10.1038/clpt.2008.170
PubMed Abstract | CrossRef Full Text | Google Scholar
Xanthos, D. N., and Sandkuhler, J. (2014). Neurogeeninen neuroinflammaatio: tulehdukselliset CNS-reaktiot vastauksena hermosolujen toimintaan. Nat. Rev. Neurosci. 15, 43-53. doi: 10.1038/nrn3617
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, H., Lauritsen, C. G., Kaiser, E. A., and Silberstein, S. D. (2017). CGRP-monoklonaaliset vasta-aineet migreeniin: perustelut ja edistyminen. BioDrugs 31, 487-501. doi: 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar