Ionisten vs. kovalenttisten yhdisteiden fysikaaliset ominaisuudet
Yleisesti ionisilla ja kovalenttisilla yhdisteillä on erilaiset fysikaaliset ominaisuudet. Ioniset yhdisteet muodostavat kovia kiteisiä kiinteitä aineita, jotka sulavat korkeissa lämpötiloissa ja kestävät haihtumista. Nämä ominaisuudet johtuvat ioniselle kiinteälle aineelle ominaisesta sisäisestä rakenteesta, jota on havainnollistettu kaavamaisesti kuvan 2.7.4 osassa (a), jossa on esitetty vahvan sähköstaattisen vetovoiman yhdessä pitämien positiivisten ja negatiivisten ionien vuorotteleva kolmiulotteinen joukko. Sitä vastoin, kuten kuvan 9.5.1 osassa (b) on esitetty, useimmat kovalenttiset yhdisteet koostuvat erillisistä molekyyleistä, joita pitävät yhdessä suhteellisen heikot molekyylien väliset voimat (molekyylien väliset voimat), vaikka kunkin molekyylin sisällä olevia atomeja pitävät yhdessä vahvat molekyylinsisäiset kovalenttiset sidokset (molekyylin sisäiset voimat). Kovalenttiset aineet voivat olla kaasuja, nesteitä tai kiinteitä aineita huoneenlämmössä ja -paineessa riippuen molekyylien välisten vuorovaikutusten voimakkuudesta. Kovalenttiset molekyyliset kiinteät aineet muodostavat yleensä pehmeitä kiteitä, jotka sulavat matalissa lämpötiloissa ja haihtuvat helposti.
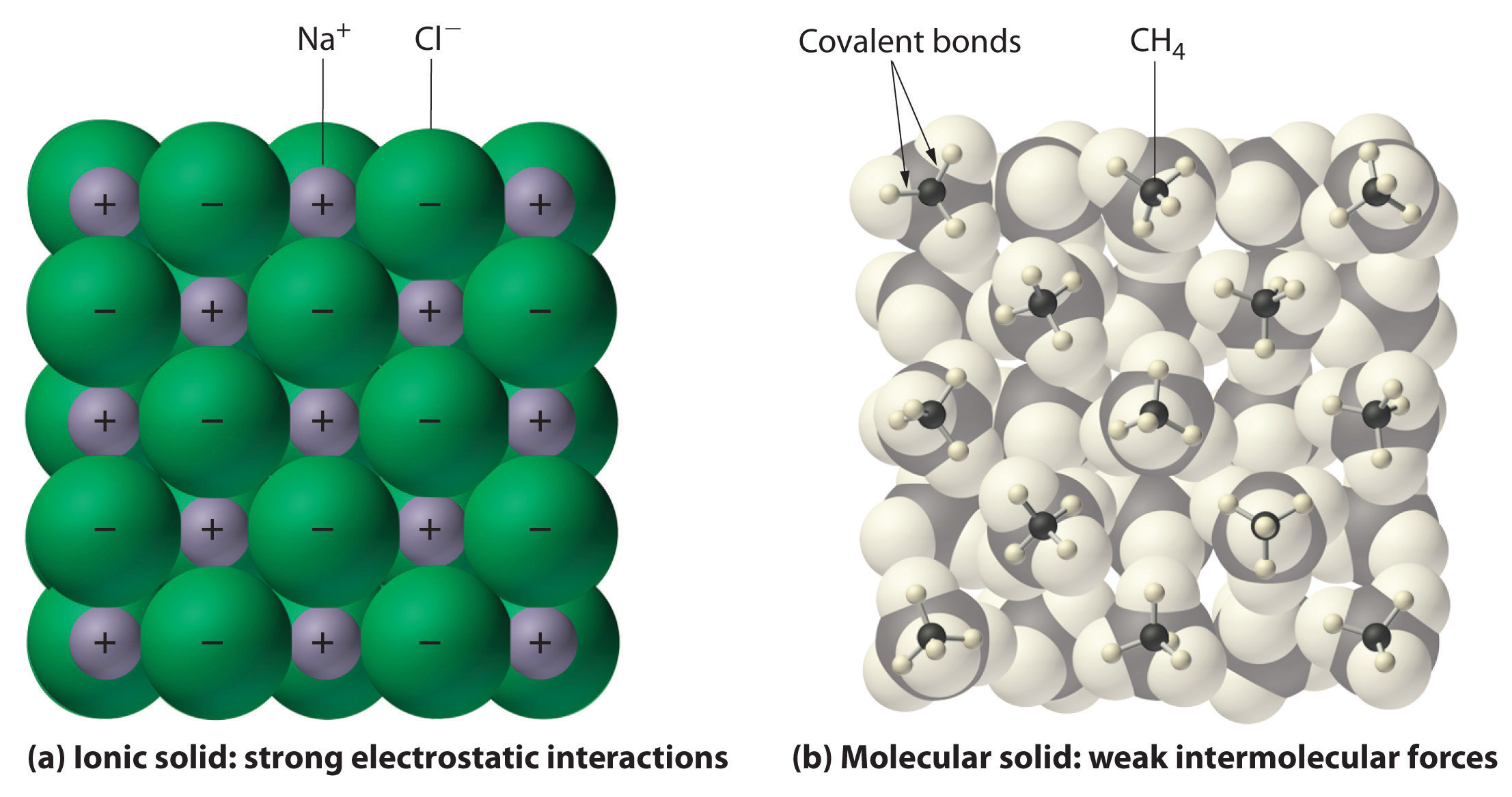
Kuva 9.5.1: Vuorovaikutukset ionisissa ja kovalenttisissa kiinteissä aineissa. (a) Ionisen kiinteän aineen, kuten natriumkloridin (NaCl), positiivisesti ja negatiivisesti varautuneita ioneja pitävät yhdessä vahvat sähköstaattiset vuorovaikutukset. (b) Tässä esityksessä metaanimolekyylien (\(CH_4\)) pakkautumisesta kiinteään metaaniin, joka on prototyyppinen molekyylinen kiinteä aine, metaanimolekyylit pysyvät yhdessä kiinteässä aineessa vain suhteellisen heikkojen molekyylien välisten voimien avulla, vaikka jokaisen metaanimolekyylin sisällä olevat atomit pysyvät yhdessä vahvojen kovalenttisten sidosten avulla.
Hiilivedyt
Molekyyliset kiinteät aineet koostuvat atomeista tai molekyyleistä, joita pitävät toisiinsa kiinnitettyinä dipoli-dipoli-vuorovaikutukset, Lontoon dispersiovoimat tai vetysidokset tai jokin näiden yhdistelmä. Molekyylien järjestys kiinteässä bentseenissä on seuraava:

Kuva 9.5.2: Kiinteän bentseenin rakenne. Kiinteässä bentseenissä molekyylit eivät ole järjestäytyneet tasojensa kanssa samansuuntaisesti vaan 90° kulmassa.
Koska molekyylisen kiinteän aineen molekyylien väliset vuorovaikutukset ovat suhteellisen heikkoja verrattuna ionisiin ja kovalenttisiin sidoksiin, molekyyliset kiinteät aineet pyrkivät olemaan pehmeitä, matalasulavia ja helposti höyrystyviä (\(ΔH__fuusio}\) ja \(ΔH_h_höyrynvuodonvuodonvuodonvuodot \)\ ovat alhaisia). Samankaltaisilla aineilla Lontoon dispersiovoimien voimakkuus kasvaa tasaisesti molekyylimassan kasvaessa. Esimerkiksi bentseenin (C6H6), naftaleenin (C10H8) ja antraseenin (C14H10), joissa on yksi, kaksi ja kolme sulautunutta aromaattista rengasta, sulamispisteet ovat vastaavasti 5,5 °C, 80,2 °C ja 215 °C. Myös fuusioentalpiat kasvavat tasaisesti sarjan sisällä: bentseeni (9,95 kJ/mol) < naftaleeni (19,1 kJ/mol) < antraseeni (28,8 kJ/mol). Jos molekyylit ovat kuitenkin muodoltaan sellaisia, että ne eivät voi pakkautua tehokkaasti yhteen kiteeseen, sulamispisteet ja sulamisentalpiat ovat yleensä odottamattoman alhaisia, koska molekyylit eivät pysty järjestäytymään siten, että molekyylien väliset vuorovaikutukset olisivat optimaalisia. Niinpä tolueenin (C6H5CH3) sulamispiste on -95 °C ja m-ksyleenin sulamispiste -48 °C, jotka ovat huomattavasti alhaisemmat kuin kevyemmän mutta symmetrisemmän analogin, bentseenin, sulamispiste.
Itsestään paraneva kumi on esimerkki molekyylisestä kiinteästä aineesta, jolla on potentiaalia merkittäviin kaupallisiin sovelluksiin. Materiaali voi venyä, mutta kun se katkeaa palasiksi, se voi liittyä uudelleen yhteen vetysidosverkostonsa uudelleenrakentamisen kautta ilman, että se osoittaa minkäänlaisia heikkouden merkkejä. Sitä tutkitaan muun muassa käytettäväksi liimoissa ja polkupyöränrenkaissa, jotka paranevat itsestään.

Kuva 9.5.3: Tolueeni ja m-ksyleeni. Tolueenin ja m-ksyleenin fenyylirenkaaseen kiinnittyneet metyyliryhmät estävät renkaita pakkautumasta yhteen yhtä hyvin kuin kiinteässä bentseenissä.