De fleste medicinske behandlinger er designet til den “gennemsnitlige patient” som en one-size-fits-all-tilgang, hvilket kan være en succes for nogle patienter, men ikke for andre. Præcisionsmedicin, undertiden kendt som “personlig medicin”, er en innovativ tilgang til skræddersyet sygdomsforebyggelse og -behandling, der tager hensyn til forskelle i menneskers gener, miljøer og livsstil. Målet med præcisionsmedicin er at målrette de rigtige behandlinger til de rigtige patienter på det rigtige tidspunkt.
Fremskridt inden for præcisionsmedicin har allerede ført til kraftfulde nye opdagelser og FDA-godkendte behandlinger, der er skræddersyet til specifikke egenskaber ved enkeltpersoner, f.eks. en persons genetiske sammensætning eller den genetiske profil af en individuel tumor. Patienter med en række forskellige kræftformer gennemgår rutinemæssigt molekylære test som en del af patientbehandlingen, hvilket sætter lægerne i stand til at vælge behandlinger, der forbedrer chancerne for overlevelse og reducerer eksponeringen for bivirkninger.
- Næste generations sekventeringstest (NGS)
- FDA’s rolle i fremme af præcisionsmedicin
- Streamlining FDA’s Regulatory Oversight of NGS Tests
- Clinical Databases Guidance
- Analytical Validation Guidance
- FDA’s bioinformatikplatform
- Spørgsmål?
- Hvad FDA’s embedsmænd siger
- NGS endelige vejledninger
- Rapporter og diskussionsoplæg
- Past Meetings
Næste generations sekventeringstest (NGS)
Præcisionspleje vil kun være lige så god som de test, der styrer diagnose og behandling. Next Generation Sequencing (NGS)-tests er i stand til hurtigt at identificere eller “sekventere” store dele af en persons genom og er vigtige fremskridt i de kliniske anvendelser af præcisionsmedicin.
Patienter, læger og forskere kan bruge disse test til at finde genetiske varianter, der kan hjælpe dem med at diagnosticere, behandle og forstå mere om menneskelige sygdomme.
FDA’s rolle i fremme af præcisionsmedicin
FDA arbejder på at sikre NGS-testers nøjagtighed, så patienter og klinikere kan modtage nøjagtige og klinisk meningsfulde testresultater.
Den store mængde oplysninger, der genereres gennem NGS, rejser nye reguleringsspørgsmål for FDA. Mens de nuværende reguleringsmetoder er hensigtsmæssige for konventionelle diagnoser, der påviser en enkelt sygdom eller tilstand (f.eks. blodsukker- eller kolesterolniveau), indeholder disse nye sekventeringsteknikker det, der svarer til millioner af test i én. Derfor har FDA arbejdet sammen med interessenter i industrien, laboratorier, den akademiske verden og patient- og faglige sammenslutninger for at udvikle en fleksibel lovgivningsmæssig tilgang for at imødekomme denne hurtigt udviklende teknologi, der udnytter konsensusstandarder, data fra mange mennesker og den nyeste open source-computerteknologi til at støtte udviklingen af NGS-test. Denne tilgang vil muliggøre innovation inden for testning og forskning og vil fremskynde adgangen til præcise, pålidelige gentests.
Streamlining FDA’s Regulatory Oversight of NGS Tests
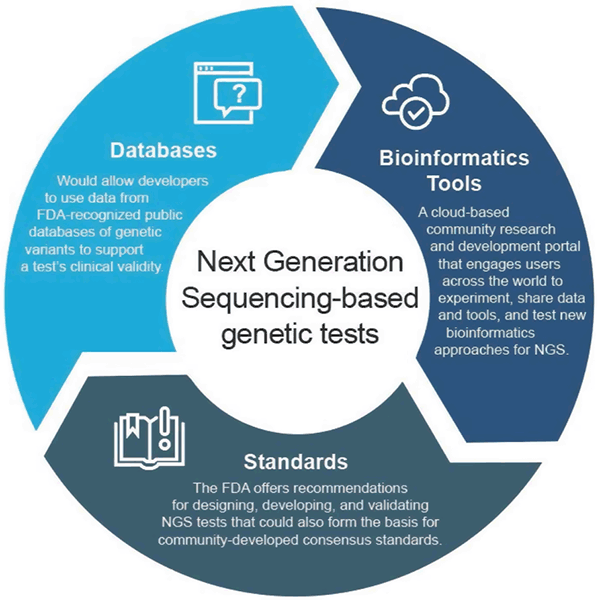
I april 2018 udstedte FDA to endelige vejledninger, der anbefaler tilgange til at strømline indsendelse og gennemgang af data, der understøtter den kliniske og analytiske validitet af NGS-baserede tests. Disse anbefalinger har til formål at give en effektiv og fleksibel tilgang til reguleringstilsyn: efterhånden som teknologien udvikler sig, kan standarderne hurtigt udvikles og bruges til at fastsætte passende målinger for hurtigt voksende områder som NGS. På samme måde kan nye påstande understøttes, efterhånden som den kliniske dokumentation forbedres. Denne adaptive tilgang vil i sidste ende fremme innovationen blandt testudviklere og forbedre patienternes adgang til disse nye teknologier.
Clinical Databases Guidance
Den endelige vejledning “Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics” giver udviklere mulighed for at bruge data fra FDA-anerkendte offentlige databaser over genetiske varianter til at understøtte en tests kliniske validitet og beskriver, hvordan databaseadministratorer kan søge anerkendelse af deres databaser, hvis de opfylder visse kvalitetsanbefalinger. Denne fremgangsmåde tilskynder til datadeling og giver en mere effektiv vej til markedet.
Der findes flere oplysninger om anerkendelse af databaser på FDA’s webside Recognition of Public Human Genetic Variants Databases (anerkendelse af offentlige databaser for humane genetiske varianter).
Analytical Validation Guidance
Den endelige vejledning “Considerations for Design, udvikling, and Analytical Validation of Next Generation Sequencing (NGS) – Based In Vitro Diagnostics (IVDs) Intended to Aid in the Diagnosis of Suspected Germline Diseases” indeholder anbefalinger til udformning, udvikling og validering af NGS-tests. Vejledningen tilskynder også til, at organisationer, der udvikler standarder (SDO’er), engagerer sig i udviklingen af NGS-relaterede standarder, da standarder hurtigere kan udvikle sig i takt med ændringer i teknologi og viden og derfor kan bruges til at fastsætte passende målepunkter såsom specifikke præstationstærskler for hurtigt voksende områder som NGS.
FDA’s bioinformatikplatform
FDA oprettede precisionFDA, en cloud-baseret fællesskabsforsknings- og udviklingsportal, der inddrager brugere over hele verden i at dele data og værktøjer til at teste, pilotteste og validere eksisterende og nye bioinformatiktilgange til NGS-behandling. Enkeltpersoner og organisationer i genomikfællesskabet kan finde flere oplysninger og tilmelde sig til at deltage på http://precision.fda.gov.
Spørgsmål?
Kontakt os venligst med spørgsmål om FDA’s indsats inden for præcisionsmedicin på [email protected].
Hvad FDA’s embedsmænd siger
- FDA færdiggør vejledninger for at fremskynde udviklingen af pålidelige, gavnlige næste generations sekventeringsbaserede tests
NGS endelige vejledninger
- Brug af offentlige humane genetiske variantdatabaser til støtte for klinisk validitet for genetiske og genomisk baserede in vitro-diagnostik – Vejledning for interessenter og medarbejdere i Food and Drug Administration (PDF – 444KB)
- Opmærksomhed ved udformning, Development, og analytisk validering af næste generations sekventering (NGS) – baseret in vitro-diagnostik (IVD’er), der er beregnet til at hjælpe med at diagnosticere formodede genetiske sygdomme – Vejledning for interessenter og ansatte i Food and Drug Administration (PDF – 1,5 km) 869KB)
Rapporter og diskussionsoplæg
- Optimering af FDA’s lovgivningsmæssige tilsyn med næste generations sekventering af diagnostiske test (PDF – 424KB)
- Rapport: Paving the Way for Personalized Medicine (Archived)
Past Meetings
- 07/27/16: Webinar – Next Generation Sequencing (NGS) Draft Guidances: Implikationer for patienter og udbydere
- 07/27/16: Webinar – Udkast til vejledninger om næste generations sekventering (NGS): Tekniske og lovgivningsmæssige aspekter
- 13/11/2015: Offentlig workshop – Brug af databaser til at fastslå den kliniske relevans af humangenetiske varianter
- 12/11/2015: Offentlig workshop – Brug af databaser til at fastslå den kliniske relevans af humangenetiske varianter
- 12/11/2015: Standardbaseret tilgang til analytisk præstationsvurdering af næste generations sekventering af in vitro-diagnostiske test
- 20/02/2015: Optimering af FDA’s lovpligtige tilsyn med næste generations sekventering af diagnostiske test Offentlige workshop