Igennem de humane Neisseria-arter og beslægtede arter reducerer tre arter – N. mucosa, M. catarrhalis og K. denitrificans – nitrat. Nitratreduktionstesten er en kritisk test til at skelne mellem N. gonorrhoeae og K. denitrificans, især når stammer af K. denitrificans ser ud til at være gramnegative diplokokokker i farvede udstrygninger.
Princip
Bakteriearter kan differentieres på grundlag af deres evne til at reducere nitrat til nitrit eller nitrogenholdige gasser. Blandt Neisseriaceae af menneskelig oprindelse reducerer stammer af Neisseria mucosa, Moraxella catarrhalis og Kingella denitrificans nitrat. Stammer af M. catarrhalis og K. denitrificans er blevet fejlidentificeret som N. gonorrhoeae. Nitratreduktionstesten gør det muligt at skelne mellem disse arter, som er nitratpositive, og N. gonorrhoeae (nitratnegativ). Reduktionen af nitrat kan være koblet til anaerob respiration hos nogle arter.
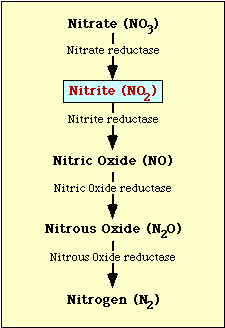
Den biokemiske vej, der er involveret i nitratreduktion, er vist i figur 1. Nitrat reduceres til nitrit, som derefter kan reduceres til nitrogenoxid, lattergas eller kvælstof (figur 1).
Figur l. Nitratreduktionsvejen.
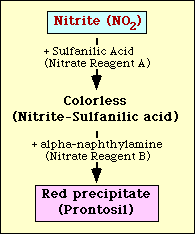
Nitratreduktionstesten er baseret på påvisning af nitrit i mediet efter inkubation med en organisme. Hvis nitrit er til stede i mediet, vil det reagere med sulfanilsyre (nitratreagens A) og danne et farveløst kompleks (nitrit-sulfanilsyre). Dette kompleks giver derefter et rødt bundfald (prontosil), når nitratreagens B (alpha-naphthylamin) tilsættes til testen, som vist i figur 2.
Figur 2. Skematisk fremstilling af påvisning af nitrit i et medium.
Der dannes kun en rød farve i mediet, når der er nitrit i mediet. Manglende rød farve i mediet efter tilsætning af sulfanilsyre og alpha-naphthylamin betyder kun, at der ikke er nitrit i mediet. Der kan være to forklaringer på denne observation:
- Nitraten kan ikke være blevet reduceret; stammen er nitrat-negativ.
Nitraten kan være blevet reduceret til nitrit, som derefter er blevet fuldstændig reduceret til nitrogenoxid, lattergas eller kvælstof, som ikke reagerer med de reagenser, der reagerer med nitrit; stammen er nitrat-positiv.
Ethvert testmedium, der giver et negativt resultat efter tilsætning af nitratreagenserne, skal testes yderligere for at afgøre, hvilken af de to fortolkninger der er korrekt.
En vellykket nitratreduktionstest er afhængig af, at testen udføres under de korrekte betingelser.
- Reaktionen vil ske bedst, hvis basismediet understøtter vækst af organismen. Selv om nogle Neisseria-arter ikke vokser godt i bouillonmedier, kan nitratreduktionstesten dog udføres med succes i et medium, der ikke understøtter vækst, ved at inokulere mediet kraftigt for at tilvejebringe tilstrækkeligt præformet enzym til, at reaktionen kan finde sted. Nitratreaktionen finder kun sted under anaerobe forhold. Det nitratholdige medium doseres i rør, så forholdet mellem overfladeareal og dybde er lavt, hvilket begrænser diffusion af ilt ind i mediet, f.eks. 5 ml medium i et rør med en diameter på 13 mm. Neisseria og beslægtede arter bruger ilten i mediet og skaber hurtigt anaerobe forhold, som er ideelle til, at nitratreduktion kan finde sted.
Nitratreduktionstesten udføres i et medium, der indeholder 0,2 % kaliumnitrat. Mediet inokuleres kraftigt med en renkultur af den mistænkte organisme og inkuberes ved 35C til 36,5C i 48 timer i en inkubator med eller uden kuldioxidtilskud.
Nitratreduktion påvises med Griess Llosvay-reagenserne, sulfanilsyre og alpha-naphthylamin. Sulfanilsyre (nitratreagens A) tilsættes til inkubationsblandingen og danner et kompleks (nitrit-sulfanilsyre) med nitrit, der måtte være til stede i mediet. Når alfa-naphthylamin (nitratreagens B) tilsættes til det inkuberede medium, dannes et rødt bundfald (prontosil) med et eventuelt nitrit-sulfankilsyrekompleks, der er til stede i mediet.
En organisme kan rapporteres som nitratpositiv, hvis der udvikles en rød farve i mediet, efter at nitratreagenser A og B er tilsat mediet, hvilket indikerer, at organismen har reduceret nitrat til nitrit.
Afstanden af en rød farve efter tilsætning af begge reagenser betyder ikke automatisk, at organismen ikke er i stand til at reducere nitrat. Stammerne kan have reduceret nitrat til nitrit og derefter reduceret nitriten fuldstændigt til nitrogenholdige gasser, som ikke påvises, når nitratreagenserne A og B tilsættes mediet. Hvis mediet ikke ændrer farve efter tilsætning af sulfanilsyre og alpha-naphthylamin, tilsættes en lille mængde (“knivspids”) zinkstøv til det inkuberede medium. Zinkstøvet vil katalysere den kemiske reduktion af nitrat til nitrit. Hvis nitraten ikke er blevet reduceret af organismerne, dvs. hvis de er nitratnegative, vil den således blive reduceret af zinkstøv, og der vil udvikle sig en rød farve i det inkuberede medium inden for 15 minutter. Hvis der ikke udvikles nogen farve i det inkuberede medium efter tilsætning af zinkstøv, har organismerne ikke blot reduceret nitrat til nitrit, men har også reduceret nitrit til nitrogenholdige gasser; disse organismer er også nitratpositive.
Og selv om nitratmediet er forsynet med omvendte Durham-rør til påvisning af gasproduktion, registreres gasproduktionen ikke for Neisseria-arter. Selv om nogle arter kan reducere nitrat ud over nitrit til nitrogenholdige gasser, ophobes der ikke nødvendigvis gas i røret. Akkumuleringen af gas er afhængig af den hastighed, hvormed den produceres. Når gassen produceres meget langsomt, kan den opløses i mediet og ikke ophobes i Durham-røret.
Prøvekrav
Optimalprøve: En ren kultur af en mistænkt gramnegativ, oxidasepositiv diplokokokker (Neisseria spp. eller M. catarrhalis) på chokoladeagar inkuberet i en kuldioxidberiget atmosfære ved 35C til 36,5C i 18 til 24 timer.
Uacceptabel prøve: Kulturer af isolater på chokoladeagar, der er inkuberet i en kuldioxidberiget atmosfære ved 35C til 36,5C i mere end 24 timer.
Kompromitterende faktorer, der påvirker testresultaterne:
- Testmediet skal være tilstrækkeligt kraftigt inokuleret til, at der kan ske reaktion med præformede enzymer. Utilstrækkeligt inokulum tillader måske ikke organismerne at bruge ilt til at skabe anaerobe forhold, hvor nitratreduktion kan finde sted.
Tilstrækkeligt zinkstøv tilsat til det inkuberede rør kan resultere i en meget hurtig reduktion af nitrat ud over nitrit til nitrogenholdige gasser, således at nitrit ikke påvises.
Prøvens stabilitet: Påvisning af nitratreduktion for Neisseria og beslægtede arter er afhængig af tilstedeværelsen af præformede enzymer.
- Testene bør kun udføres med inokulum, der er høstet fra 24 timers kulturer.
- Nitratmedium bør inokuleres inden for 30 min. efter at kulturen er taget ud af inkubatoren; længere tids eksponering af kulturen ved stuetemperatur kan resultere i nedsat enzymaktivitet.
Medium/Reagenser
Medium: Nitratbuljong (Hjerteinfusionsbuljong indeholdende 0,2 % kaliumnitrat)
Hjerteinfusionsbuljong (Difco), 25,0 g
Kaliumnitrat, 2,0 g
Distilleret vand, 1000,0 ml
- Opløs ingredienserne i destilleret vand; juster opløsningen til pH 7.0.
Dispensier 5 ml alikvater af bouillonen i 16 mm x 100-mm-rør med gasindsats (Durham-rør, 6-mm x 50-mm). Autoklave i 15 min. ved 121C.
Lagre mediet ved 4C til 10C (på køl), indtil det anvendes. Forvarm mediet til stuetemperatur før inokulering.
Reagenser: Sulfanilsyreopløsning (Nitratreagens A): 0,8 % i 5N eddikesyre
Kemisk navn:
Opbevares ved 15-30 C (stuetemperatur) i op til 3 måneder i mørke. Reagenserne kan opbevares i mørkebrune glasbeholdere; flaskerne kan pakkes ind i aluminiumsfolie for at sikre mørke.
Alpha-naftylaminopløsning (nitratreagens B): 0,6% i 5N eddikesyre
Cemisk navn: N,N-dimethyl-1-naphthylamin
Lagre nitratreagens B ved 2-8 °C (køleskab) i op til 3 måneder i mørke. Reagenserne kan opbevares i mørkebrune glasbeholdere; flaskerne kan pakkes ind i aluminiumsfolie for at sikre mørke.
Zinkpulver, Reagenskvalitet: Opbevares ved stuetemperatur (15C til 30C)
Varsel: Eddikesyre er ætsende. Kontakt med huden kan forårsage blærer og forbrændinger. I tilfælde af kontakt skal øjne og hud straks skylles med rigeligt vand (i mindst 15 min.)
Kvalitetskontrol/prøvningsprocedure
QC-stammer:
- Nitratreduktase-positiv kontrol:
- Nitratreduktase-positiv kontrol: Kingella denitrificans, CDC 10.236
Nitratreduktase-negativ kontrol: Kingella denitrificans, CDC 10.236
Nitratreduktase-negativ kontrol: Neisseria gonorrhoeae, ATCC 43069
QC-stammer opbevares ved -70C i en opløsning af tryptisk sojabouillon indeholdende 20 % glycerol. Reaktioner af kontrolstammer bør bekræftes på det tidspunkt, hvor de frosne lagre fremstilles. QC-stammer kan opbevares ved -70C i op til 2 år.
Procedure:
QC-stammer testes på samme måde som kliniske isolater. QC-stammer skal subkultiveres mindst én gang efter den første dyrkning fra den frosne prøve, før testen udføres. Kliniske isolater kan subkultiveres fra selektivt medium eller rensede subkulturer. Det skal sikres, at kulturerne er rene.
- Opvarm hætteglas med kontrolstammer, der er opbevaret ved -70C. Sæt dem på plader med chokoladeagar eller suppleret GC-agar med henblik på isolering. Inkubér ved 35C til 36,5C i en kuldioxidberiget atmosfære i 18 til 24 timer.
- Inkubér inokulerede medier og et uinokuleret kontrolmedie i et rør med kontrolmedie ved 35C til 36,5 C i en kuldioxidberiget atmosfære i 48 timer.
-
Efter 48 timers inkubation tilsættes med Pasteur-pipetter 5 dråber reagens #A, efterfulgt af 5 dråber reagens #B til hvert rør. Ryst røret godt for at blande reagenserne med mediet.
Undersøg suspensionen for en lyserød farve, som bør udvikle sig inden for få minutter, hvis mediet stadig er varmt. Reaktionen kan tage lidt længere tid, hvis mediet er koldt, når reagenserne tilsættes.
Hvis suspensionen bliver lyserød inden tilsætningen af Zn-pulver, er reaktionen positiv, og testen er afsluttet. Trin 4 skal ikke udføres.
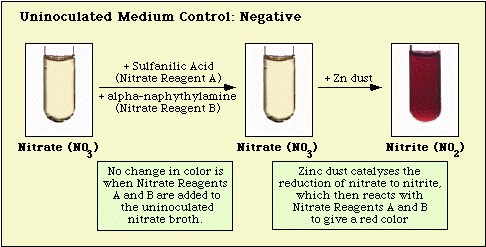
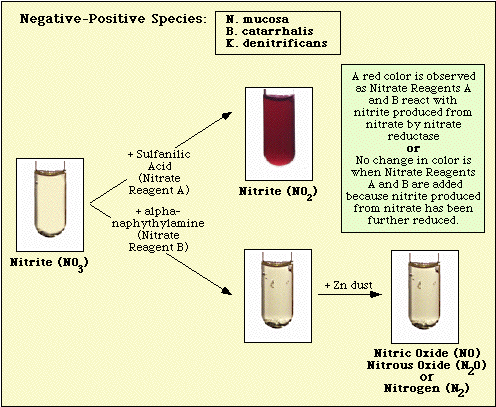
Reaktioner, der er observeret med det uinokulerede kontrolmedium og nitrat-negative og nitrat-positive isolater, er illustreret i henholdsvis figur 3, figur 4 og figur 5.
-
Hvis suspensionen er farveløs efter tilsætning af reagens A og B, tilsættes en lille mængde (4 til 5 mg; “skarp knivspids”) zinkstøv til mediet. Ryst røret kraftigt og lad det stå ved stuetemperatur i 10-15 min.
Hvis mediet forbliver farveløst efter tilsætning af Zn-pulver, er testresultatet positivt.
Hvis mediet bliver lyserødt efter tilsætning af Zn-pulver, er resultatet negativt. - Læs resultaterne af og noter dem.
Med en steril vatpind fremstilles en kraftig suspension af velisolerede kolonier fra en renkultur af isolatet, der er inkuberet på chokolademedium ved 35C til 36C.5 C i en kuldioxidberiget atmosfære i 18 til 24 timer. Inokulér testmediet, så det giver kraftig turbiditet.
Bemærkning: Stammer af N. gonorrhoeae og nogle andre Neisseria spp. vokser muligvis ikke i dette medium. Reaktionen kan således være afhængig af præformet enzym.
Figur 3. Reaktionen observeret med uinokuleret nitratmedium.
Figur 4. Reaktionen observeret med nitratnegative arter.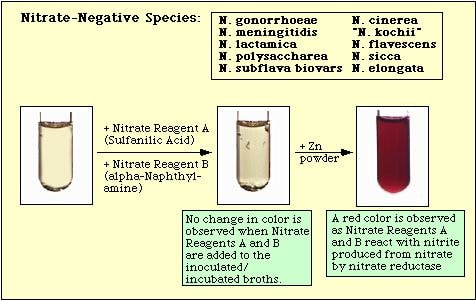
Figur 5. Reaktioner observeret med nitratpositive arter.
Skema for kvalitetskontrol:
- Der udføres en nitratreduktase QC-test hver dag, kliniske isolater testes.
Problemer & Løsninger
Nitratreduktionstesten kan give falsk-negative eller falsk-positive resultater, hvis mediet ikke er fremstillet korrekt, eller testen ikke udføres korrekt. Reaktionen i denne test er afhængig af en række faktorer.
- Det kan skyldes (1) at mediet ikke indeholder nitrat eller (2) at der er tilsat for meget zinkstøv, som har katalyseret reduktionen af nitrat ud over nitrit til nitrogenholdige gasser, hvis der ikke kan påvises lyserød farve i kontrolrøret med det uinokulerede medium efter tilsætning af Zn-støv. Den enkleste løsning er at fremskaffe mere nitratmedium og sikre, at der er tilsat nitrat til grundmediet. Alternativt kan man inokulere mediet med en positiv kontrolstamme, men teste for en reaktion efter en kortere inkubationstid; stammer af N. mucosa vil give en positiv nitritreaktion efter et par timers inkubation. Hvis det bekræftes, at mediet indeholder nitrat, gentages testen, indtil man har bestemt den korrekte mængde zinkstøv, der skal tilsættes. Det er afgørende at lære, hvor meget zinkstøv der skal tilsættes til testen. Tilsætning af for meget zinkstøv kan resultere i et falsk positivt resultat.
- Nitratreduktionsreaktionen angiver organismernes evne til at reducere nitrat, en reaktion, der kun forekommer under anaerobe forhold; reaktionen vil ikke forekomme, hvis organismerne får en kontinuerlig tilførsel af ilt. Reaktionen kan således ikke forekomme i stillestående kulturer (især af langsomtvoksende arter), hvor mediet er fordelt i lavvandede lag, der tillader ilt at diffundere ind i mediet. En test til bestemmelse af, om der er ilt til stede i mediet, kan foretages ved at tilsætte en dråbe oxidasereagens til mediet. Hvis mediet bliver lilla, indeholder mediet ilt, og nitratreduktionsreaktionen kan ikke finde sted. Hvis mediet forbliver farveløst, indeholder mediet ikke ilt, og nitratreduktionsreaktionen kan finde sted. Det er blevet bemærket, at N. gonorrhoeae-cellerne opbruger ilten hurtigt, hvis der inokuleres tilstrækkeligt mange celler i mediet. Hvis der tilsættes oxidasereagens efter ca. 1 til 2 timers inkubation, forbliver mediet klart. Da oxidasereagenset dræber de gonokokker, der er til stede i mediet, vil mediet gradvist blive lilla, begyndende i toppen af røret, efterhånden som ilten diffunderer ind i mediet. Hvis mediet udleveres i rør med andre dimensioner end dem, der er foreslået ovenfor, skal det sikres, at forholdet mellem overfladeareal og dybde er mindst lige så stort som eller mindre end dem, der er foreslået ovenfor. Hvis diameteren på det rør, hvori mediet afgives, er større end den ovenfor beskrevne, skal der anvendes en større mængde medium for at opretholde det samme forhold mellem overfladeareal og dybde.
- Når reagens A tilsættes testmediet, vil nitrit, der dannes som følge af reduktionen af nitrat, danne et kompleks med sulfanilsyre, der danner et rødt bundfald med alfa-naphthylaminet i reagens B. Tilstedeværelsen af en rød farve i testmediet viser, at der er nitrit til stede som følge af reduktionen af nitrat. Manglende rød farve efter tilsætning af reagens A og B betyder imidlertid ikke nødvendigvis, at nitratet ikke er reduceret. Hvis der ikke udvikles en rød farve, kan det betyde 1) at nitraten ikke er blevet reduceret, eller 2) at nitriten, der dannes som følge af nitratreduktionen, selv er blevet reduceret til nitrogenholdige gasser. For at afgøre, om nitriten er blevet reduceret, anbringes en lille mængde zinkstøv i inkubationsblandingen, hvis den er farveløs efter tilsætning af reagens A og B. Zinkstøv katalyserer reduktionen af nitrat til nitrit; der skal udvikles en rød farve i det medium, der stadig indeholder ureduceret nitrat. Det er dog vigtigt, at der ikke tilsættes for meget zinkstøv; overskydende zinkstøv vil katalysere reduktionen af nitrit produceret fra dette nitrat, hvilket resulterer i et farveløst medium og en forkert fortolkning af testen som positiv (et falsk-positivt resultat).
- En positiv nitratreduktase-test opnås med den negative kontrolstamme, N. gonorrhoeae, efter tilsætning af zinkstøv indikerer, at nitratet er blevet reduceret ud over nitrit, hvilket sandsynligvis skyldes, at der er tilsat for meget zinkstøv til testen. Testen gentages, idet det sikres, at der tilsættes meget lidt zinkstøv. Den lyserøde farve, der viser, at organismen ikke har reduceret nitrat, kan tage 10 til 15 minutter at udvikle sig. Der må ikke tilsættes mere zinkstøv! Vent på, at farven udvikler sig. Hvis der ikke er udviklet farve efter 30 min. fortolkes testen som positiv.
Hvis der påvises en lyserød farve i det uinokulerede kontrolmedium, efter at nitratreagens A og B er blevet tilsat mediet, er mediet forurenet med nitrit. Den eneste løsning er at fremskaffe et nyt parti medium, der ikke er forurenet med nitrit. I et medium, der indeholder nitrat, vil den positive kontrolstamme, Kingella denitrificans, kun give en positiv reaktion, hvis stammen ikke er K. denitrificans. Kontrollér igen identiteten af den positive kontrolstamme. Der vælges en ny kultur af kontrolstammen, og testen gentages. Hvis der på samme måde opnås en positiv nitratreduktaseprøve med den negative kontrolstamme, N. gonorrhoeae, er enten den negative kontrolstamme ikke N. gonorrhoeae, eller også er kulturen kontamineret med en nitratpositiv organisme. Gonokokkerreferencestammens renhed og identitet kontrolleres på ny. Gentag testen med en ren kultur af en bekræftet kultur af N. gonorrhoeae.
Nitratreduktionsreaktionen kan ikke finde sted, hvis det medium, hvori testen udføres, ikke tillader normal vækst af organismen. Testen kan dog udføres i et medium, der ikke understøtter vækst af organismerne, hvis inokulumet er tilstrækkeligt tæt til, at de foruddannede enzymer kan opbruge den eksisterende iltforsyning og reducere nitratet med en hurtigere hastighed end den, hvormed ilten diffunderer ind i mediet.
Note: For at kontrollere, at ilten er fjernet fra mediet, tilsættes 2 til 3 dråber oxidasereagens til en duplikat af det inokulerede medium. Hvis ilten er blevet tilstrækkeligt fjernet fra mediet, bliver oxidasereagenset ikke straks lilla med det samme. Hvis mediet indeholder opløst ilt, vil oxidasereagenset blive lilla. Bemærk også, at nitratreduktionstesten kan udføres i et medium, som er tilsat oxidasereagenset.
Begrænsninger ved testen
Hvis testen udføres korrekt, og kvalitetskontrolstammer giver passende resultater, bør der ikke være nogen begrænsninger ved denne test. Det skal sikres, at alle komponenter i testen udføres korrekt.
Ingen identifikation af slægt eller art kan foretages på grundlag af nitratreduktionstesten alene.
Resultater, fortolkning og rapportering
Isolater kan rapporteres som nitratpositive, hvis der påvises nitrit (lyserød farve) i det inokulerede medium efter tilsætning af reagens A og B, eller hvis der ikke påvises nogen farve i mediet efter tilsætning af zinkstøv.
Isolater kan rapporteres som nitrat-negative, hvis der ikke påvises nitrit (ingen farveændring) efter tilsætning af reagens A og B, eller hvis der udvikles en lyserød farve efter tilsætning af zinkstøv til det inokulerede medium.
Bibliografi
Knapp JS, Clark VL. Anaerob vækst af Neisseria gonorrhoeae koblet til nitritreduktion. Infect Immun 1984;46;46:176-181.
Skerman VBD. 1967. p.218 – 220. En vejledning i identifikation af bakterieslægter. The Williams & Wilkins Co., Baltimore, MD.