Mekaniske komplikationer af akut myokardieinfarkt (AMI) er ventrikelseptumdefekt (VSD), papillarmuskelruptur eller -dysfunktion, ruptur af den frie væg i hjertet, ventrikulært aneurisme, dynamisk obstruktion af venstre ventrikels (LV) udstrømningskanal (OT) og højre ventrikelsvigt (RV). Alle disse tilstande kan potentielt føre til LV-svigt med kardiogent shock.
En grundig forståelse af de mekaniske komplikationer ved AMI og deres risikofaktorer kan hjælpe klinikere med at stille en tidlig diagnose. For at opnå gunstige patientresultater er det nødvendigt med en hurtig diagnose med passende medicinsk behandling og rettidig kirurgisk indgriben. Vigtige faktorer for dødelighed på hospitalet som følge af mekaniske komplikationer ved MI omfatter høj alder, kardiogent shock og kardiorespiratorisk svigt.
Ventrikulær frivægsruptur
VFWR er den mest alvorlige komplikation ved AMI. VFWR er normalt forbundet med store transmurale infarkter og antecedent infarktekspansion. Det er den hyppigste dødsårsag, kun overgået af LV-svigt, og den tegner sig for 15-30 % af de dødsfald, der er forbundet med AMI. VFWR er ubestrideligt den mest katastrofale af de mekaniske komplikationer og fører til akut hæmoperikardie og død som følge af hjertetamponade.
Den samlede forekomst af VFWR varierer fra 0,8-6,2 %. Incidensen af denne komplikation er faldet gennem årene med bedre 24 timers systolisk blodtrykskontrol; øget brug af reperfusionsbehandling, betablokkere og ACE-hæmmere; og mindre brug af heparin .
Data fra National Registry of Myocardial Infarction (NRMI) viste en forhøjet incidens af in-hospital mortalitet blandt patienter, der fik trombolysebehandling (12,1 %) end blandt patienter, der ikke fik trombolysebehandling (6,1 %). I TIMI II-forsøget (Thrombolysis in Myocardial Infarction Phase II) døde 16 % af patienterne af hjertekrampe inden for 18 timer efter behandlingen. Patienter, der gennemgik perkutan transluminal koronar angioplastik (PTCA), havde en lavere forekomst af ruptur af den frie væg end patienter, der modtog trombolysebehandling.
Risikofaktorer for VFWR omfatter høj alder over 70 år, kvindelig køn, ingen tidligere MI’er, Q-bølger på EKG, hypertension i den indledende fase af STEMI, brug af kortikosteroid eller NSAID og fibrinolytisk behandling mere end 14 timer efter STEMI-debut. Patienter med angina pectoris i fortiden, tidligere AMI, koronar sygdom med flere kar og kronisk hjertesvigt er mindre tilbøjelige end andre til at udvikle VFWR i LV, fordi de udvikler kollateraler og iskæmisk prækonditionering.
Klinisk præsentation af VFWR
VFWR’er er dramatiske; de præsenterer sig akut eller lejlighedsvis subakut som pseudoaneurismer; og de involverer oftest LV’s forreste eller laterale væg. De fleste VFWR’er opstår inden for den første uge efter AMI.
Becker et al klassificerede følgende 3 typer af VFWRs :
-
Type I – en pludselig slidslignende rift, der ofte er forbundet med anteriore infarkter, og som opstår tidligt (inden for 24 timer)
-
Type II –
-
Type II – en en erosion af infarktmyokardiet på grænsen mellem det infarkte og det levedygtige myokard
-
Type III – en tidlig aneurysmedannelse, der korrelerer med ældre og stærkt udvidede infarkter
Type III opstår normalt senere end type I- eller type II-rupturer. Trombolytisk behandling fremskynder forekomsten af kardielruptur i Becker type I og type II VFWR’er. Ved svært udvidede infarkter (type III) mindsker trombolytisk behandling forekomsten af hjerteklapsruptur.
Et pseudoaneurisme dannes, når tilstødende perikardie og hæmatom forsegler en myokardieruptur eller -perforation. Væggen i et pseudoaneurisme er oftest visualiseret som en aneurysmisk udposning, der kommunikerer med LV-hulen ved hjælp af en smal hals. Denne væg består af perikardiet og organiseret trombe og/eller hæmatom. Den er blottet for myokardieelementer, hvorimod et ægte aneurisme har alle elementer fra den oprindelige myokardievæg og en relativt bred base. Pseudoaneurysmet kan variere i størrelse og har stor risiko for at rupturere.
Den kliniske præsentation af VFWR varierer afhængigt af rupturens skarphed, placering og størrelse. Patienter med akut VFWR præsenterer sig med stærke brystsmerter, pludselig elektromekanisk dissociation eller asystoli, hæmodynamisk kollaps og muligvis død. Hos ca. en tredjedel af patienterne er forløbet subakut, og de præsenterer symptomer som synkope, hypotension, chok, arytmi og langvarige og tilbagevendende brystsmerter.
Diagnose af VFWR
Frølig diagnose af VFWR og intervention er afgørende for patientens overlevelse. Der kræves et højt mistænkeindeks, når patienter med AMI præsenterer sig med alvorlige brystsmerter, chok eller arytmier og pludselig udvikling af elektromekanisk dissociation. EKG-tegn for forestående VFWR har begrænset specificitet, men omfatter sinustakykardi, intraventrikulær ledningsdefekt og vedvarende eller tilbagevendende ST-segmentelevation.
Ekokardiografi er det diagnostiske redskab at foretrække. Det vigtigste diagnostiske fund er en moderat til stor perikardieeffusion med kliniske og ekkokardiografiske tegn på forestående perikardietamponade. Hos patienter med hjertetamponade og elektromekanisk dissociation øger moderat til svær perikardieeffusion dødelighedsrisikoen. Patienter uden initial hjertetamponade bør, selv om de har en lavere dødelighed, stadig følges, da der stadig kan forekomme sen ruptur. Fravær af perikardieeffusion ved ekkokardiografi har en høj negativ prædiktiv værdi. Hvis evnen til at opnå transthorakale ekkokardiogrammer er begrænset hos patienter, der modtager mekanisk ventilation, kan transøsofageal ekkokardiografi hjælpe med at bekræfte VFWR.
MRI giver en overlegen billedkvalitet og gør det muligt at identificere stedet og anatomien af et ventrikulært pseudoaneurisme (dvs. et ruptureret LV, der er tilbageholdt af perikardiet med en lukket blodprop). MRI er imidlertid af begrænset anvendelse i den akutte situation på grund af den tid, det tager, og fordi billeddannelsesenhederne ikke kan transporteres.
Behandling af VFWR
Den vigtigste forebyggelsesstrategi er tidlig reperfusionsbehandling, hvor perkutan koronar intervention (PCI) er den foretrukne modalitet. Fibrinolytisk behandling er forbundet med en generelt nedsat risiko for VFWR; anvendelse heraf mere end 14 timer efter STEMI-udbrud kan dog øge risikoen for tidlig ruptur.
Standardbehandlingen af VFWR er akut kirurgisk reparation, efter at der er opnået hæmodynamisk stabilitet. Patienterne kan først have brug for intravenøse væsker, inotrope midler og akut pericardiocentese.
Pifarré og medarbejdere anbefalede indsættelse af en intra-aortisk ballonpumpe for at mindske den systoliske efterlast og forbedre den diastoliske myokardieperfusion.
Der er anvendt flere kirurgiske teknikker, herunder infarktektomi, klæbning med biologiske limplaster af polyethylenterephthalatpolyesterfibre (Dacron; DuPont, Wilmington, DE) eller polytetrafluorethylenfluorpolymerharpiks (Teflon; DuPont) og anvendelse af pantsatte suturer uden infarktektomi.
Dødeligheden er betydeligt høj og afhænger i høj grad af patientens præoperative hæmodynamiske status. Tidlig diagnose, hurtig iværksættelse af de ovenfor beskrevne foranstaltninger for at opnå hæmodynamisk stabilitet og hurtig kirurgisk reparation kan forbedre overlevelsesraten. En opfølgning på det randomiserede Acorn-forsøg påviste langsigtet forbedring af venstre ventrikels struktur og funktion efter mitralklapoperation i op til 5 år. Disse data giver dokumentation til støtte for mitralklapreparation i kombination med Acorn CorCap-enheden til patienter med ikke-iskæmisk hjertesvigt med alvorlig venstre ventrikeldysfunktion, som er blevet medicinsk optimeret, men som fortsat har symptomer med betydelig mitralregurgitation.
Ventrikelseptumruptur
VSR er en sjældent forekommende, men livstruende komplikation ved AMI. Trods optimal medicinsk og kirurgisk behandling har patienter med VSR en høj dødelighed på hospitalet. I den prætrombolytiske æra forekom VSR’er hos 1-3 % af personer med MI’er. Incidensen faldt med trombolysebehandling (til 0,2-0,34 %) på grund af forbedringer i reperfusion og myokardisk redning. Den bimodale fordeling af VSR er karakteriseret ved en høj forekomst i de første 24 timer, med et andet højdepunkt på dag 3-5 og sjældent mere end 2 uger efter AMI.
I patienter, der modtager trombolytika, var mediantiden fra symptomdebut på AMI til septalruptur 1 dag i GUSTO-I-forsøget (Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries) og 16 timer i GUSTO-I-forsøget (Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock? (SHOCK)-forsøget.
Risikofaktorer for septumruptur omfatter høj alder (>65 år), kvindelig køn, enkeltkarssygdom, omfattende MI og dårlig septal kollateral cirkulation. Før fremkomsten af trombolytika var hypertension og fravær af angina pectoris i anamnesen risikofaktorer for VSR. Omfattende infarktstørrelse og RV-involvering er andre kendte risikofaktorer for septalruptur.
I patienter med AMI uden reperfusion udvikles koagulationsnekrose inden for 3-5 dage efter infarktet. Neutrofile migrerer til den nekrotiske zone og gennemgår apoptose, frigiver lytiske enzymer og fremskynder opløsningen af nekrotisk myokardie. Nogle patienter har infarkter med store intramurale hæmatomer, som dissekerer ind i vævet og resulterer i tidlig septumruptur. Størrelsen af septumrupturen varierer fra et par millimeter til flere centimeter.
VSR kategoriseres som simpel eller kompleks afhængigt af dens længde, forløb og placering. Ved simpel septumruptur er perforationen på samme niveau på begge sider af septum, og der er en direkte gennemgående kommunikation på tværs af septum. En kompleks septumruptur er karakteriseret ved omfattende blødning med uregelmæssige, serpiginøse trakter i det nekrotiske væv.
Septumrupturer er mest almindelige hos patienter med store anteriore MI’er som følge af okklusion af LAD-arterien, der forårsager omfattende septuminfarkter. Disse infarkter er forbundet med ST-segmentforhøjelser og Q-bølger i inferior afledning (II, III, aVF), og disse EKG-forandringer ses derfor hyppigere ved septalrupturer. Disse rupturer er generelt apikale og simple.
Septalrupturer hos patienter med inferiort MI forekommer relativt sjældent. Disse rupturer involverer det basale inferoposteriorseptum og er ofte komplekse.
Klinisk præsentation af VSR
Symptomer på VSR som komplikation til AMI omfatter brystsmerter, åndenød, hypotension, biventrikulært svigt og shock inden for timer til dage. Patienterne præsenterer sig ofte med en ny, høj og hård holosystolisk mislyd. Denne mislyd er højest langs den nederste venstre sternalgrænse og er forbundet med en palperbar parasternal systolisk thrill. RV- og LV S3-galopper er almindelige.
Hos patienter med kardiogent shock som følge af septumruptur kan det være vanskeligt at identificere murren og thrill. I modsætning hertil har patienter med akut MR ofte en blød systolisk murren ved apex uden thrill.
Diagnostik af VSR
Ekokardiografi med farveflowdoppler-billeddannelse er det foretrukne diagnostiske værktøj til identifikation af VSR. (Se billedet nedenfor.) Dens sensitivitet og specificitet er blevet rapporteret til at være så høj som 100 %. Desuden kan den bruges til følgende:
-
Detektere stedet og størrelsen af septumrupturen
-
Vurdere LV og RV funktion
-
Vurder det systoliske RV-tryk
-
Kvantificer det venstre-til-højre-shunt
Der kræves normalt en hjertekateterisation for at bekræfte diagnosen, kvantificere graden af venstre-højre shunt, skelne VSR fra andre tilstande (f.eks. mitralinsufficiens) samt visualisere kranspulsårerne.
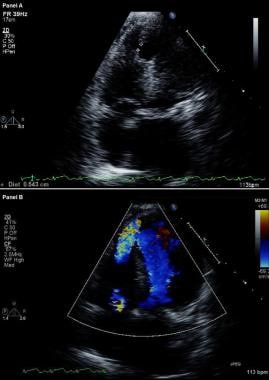
 Komplikationer ved myokardieinfarkt. Modificeret todimensionelt (øverst) ekkokardiogram og farveflow-dopplerbillede (nederst). Apikale firekammerbilleder viser et brud i det interventrikulære septum og fri kommunikation mellem ventriklerne gennem en stor apikal septum ventrikulær septumdefekt hos en patient, der for nylig har haft et anterior myokardieinfarkt.
Komplikationer ved myokardieinfarkt. Modificeret todimensionelt (øverst) ekkokardiogram og farveflow-dopplerbillede (nederst). Apikale firekammerbilleder viser et brud i det interventrikulære septum og fri kommunikation mellem ventriklerne gennem en stor apikal septum ventrikulær septumdefekt hos en patient, der for nylig har haft et anterior myokardieinfarkt. I patienter med VSR viser højre hjertekateterisation en optrapning i iltmætningen fra højre atrium til RV; i modsætning hertil forekommer der ingen optrapning i iltmætningen blandt patienter med MR. Tilstedeværelsen af store V-bølger i den pulmonale kapillære kilekilsporing understøtter diagnosen alvorlig akut MR.
Venstre ventrikulografi kan også bruges til at identificere stedet for ventrikulær ruptur (se Kardiakateterisering ). Denne undersøgelse er dog normalt unødvendig, efter at der er foretaget en ekkokardiografisk og Doppler-undersøgelse af god kvalitet.
Behandling af VSR
Nøglen til behandling af VSR er hurtig diagnose og en aggressiv tilgang til hæmodynamisk stabilisering, angiografi og kirurgi. Den optimale tilgang omfatter hæmodynamisk stabilisering med administration af ilt og mekanisk støtte med brug af en intra-aortisk ballonpumpe samt administration af vasodilatatorer (for at reducere efterbelastningen og dermed LV-trykket og venstre-højre-shunten), diuretika og inotrope midler.
Hertekateterisering er nødvendig for at definere den koronare anatomi; dette efterfølges af akut kirurgisk reparation.
I en undersøgelse af 52 konsekutive patienter med postinfarktventrikulær septumruptur, der blev kirurgisk repareret, fandt investigatorerne, at 30-dages mortalitetsraten var 36 % (n = 19). De fleste patienter, der overlevede i mindre end 30 dage, havde en præoperativ chokstatus. Undersøgerne konkluderer, at det for patienter med ventrikelseptumruptur er nødvendigt med en præoperativ forbedring af chokstatus og aggressiv koronar revaskularisering.
Medicinsk behandling er kun beregnet til midlertidig stabilisering før operation, da de fleste patienters tilstand forværres hurtigt, og de dør i mangel af kirurgisk indgreb. I GUSTO-I-forsøget var 30-dages dødeligheden lavere hos patienter med VSR, der gennemgik en kirurgisk reparation, end hos patienter, der blev behandlet medicinsk (47 % vs. 94 %), ligesom 1-års dødeligheden var lavere (53 % vs. 97 %). Lemery et al. rapporterede en 30-dages overlevelsesrate på 24 % hos patienter, der blev behandlet medicinsk, sammenlignet med 47 % hos dem, der blev behandlet kirurgisk.
Retningslinjer fra American College of Cardiology/American Heart Association (ACC/AHA) for behandling af patienter med septumruptur som komplikation til AMI fremhæver akut kirurgisk indgreb, uanset deres kliniske status. Kirurgisk behandling af septumruptur omfatter følgende elementer:
-
Snarlig etablering af hypotermisk kardiopulmonal bypass
-
En tilgang til septumrupturen gennem infarktområdet og excision af alle nekrotiske, sprøde margener af septum og ventrikulære vægge for at undgå postoperativ blødning, residuel septumdefekt, eller begge dele
-
Rekonstruktion af septum og ventrikulære vægge ved hjælp af protesemateriale og bevarelse af ventriklerne geometriske konfiguration og hjertefunktion
Percutan lukning af septumruptur er en relativt ny tilgang, som anvendes hos udvalgte patienter som et alternativ til kirurgisk reparation eller til akut stabilisering af kritisk syge patienter. Imidlertid er perkutan lukning i øjeblikket ikke tilgængelig i mange institutioner, og der foreligger ingen data om langtidsresultater.
I flere undersøgelser er det ikke lykkedes at påvise en sammenhæng mellem perioperativ mortalitet og samtidig koronar revaskularisering (koronar bypass-grafting). Patienter med kardiogent chok som følge af septumruptur har det dårligste resultat. I SHOCK-forsøget var dødeligheden på hospitalet højere hos patienter med kardiogent shock som følge af septumruptur (87,3 %) end hos patienter med kardiogent shock af alle andre årsager (59,2 % med ren LV-svigt og 55,1 % med akut MR).
I patienter, der overlever en kirurgisk reparation, rapporteres det, at der er ca. 28 % recidiv eller residual septumdefekt, og den dermed forbundne dødelighed er høj.
Et gentaget kirurgisk indgreb er indiceret hos patienter, der har klinisk hjertesvigt eller en pulmonal-systemisk fraktion større end 2.
Akut mitralregurgitation
MR er en almindelig komplikation efter AMI, der skyldes lokal og global LV-remodellering, og som er en uafhængig prædiktor for hjertesvigt og død. MR opstår typisk 7-10 dage efter en AMI, selv om denne indtræden kan variere alt efter MR-mekanismen. Papillarmuskelruptur, der resulterer i MR, opstår inden for 1-14 dage (median, 1 d).
Mild til moderat MR er ofte klinisk tavs og påvises ved Doppler-echokardiografi udført i den tidlige fase af AMI. I sådanne tilfælde forårsager MR sjældent hæmodynamisk kompromittering.
Speckle tracking og 3-dimensionel ekkokardiografi viste sig at være vigtige billeddannelsesværktøjer til vurdering af omvendt LV-remodellering efter operation for degenerativ mitralklapregurgitering. Subtile regionale præoperative regionale præoperative ændringer i den diastoliske funktion af septal- og lateralvæggen kunne identificeres præoperativt, hvilket bidrog til optimering af henvisningstidspunktet og til at genkende potentielle syndere som indikatorer for sygdomsrecidiv efter mitralreparation.
Svær akut MR, der skyldes ruptur af papillarmuskler eller chordae tendineae, resulterer i pludselig hæmodynamisk forværring med kardiogent shock. Hurtig diagnose, hæmodynamisk stabilisering og hurtig kirurgisk intervention er nødvendig, fordi akut alvorlig MR er forbundet med en høj dødelighed.
Den rapporterede forekomst af MR kan variere på grund af flere faktorer, herunder de anvendte diagnosemetoder, tilstedeværelsen eller fraværet af hjertesvigt, den rapporterede grad af MR, den anvendte behandlingstype og tiden fra infarktdebut til testning.
I GUSTO-I-forsøget var forekomsten af MR hos patienter, der modtog trombolytisk behandling, 1,73 %. I SHOCK-forsøget, som omfattede MI-patienter, der præsenterede sig med kardiogent shock, blev der konstateret en 39,1 % forekomst af moderat til svær MR. Kinn et al. rapporterede, at reperfusion med angioplastik resulterede i et fald på 82 % i hyppigheden af akut MR sammenlignet med trombolytisk behandling (0,31 % vs. 1,73 %).
Risikofaktorer for MR er høj alder, kvindeligt køn, stort infarkt, tidligere AMI, tilbagevendende iskæmi, multivessel koronararteriesygdom og hjertesvigt.
Flere mekanismer kan forårsage MR efter AMI. Ruptur af papillarmusklen er den mest almindeligt rapporterede mekanisme.
En sådan ruptur forekommer hos 1 % af patienterne med AMI og involverer ofte den posteromediale papillarmuskel snarere end den anterolaterale papillarmuskel, da førstnævnte har en enkelt blodforsyning i modsætning til den dobbelte forsyning for sidstnævnte. Papillærmuskelruptur kan føre til flailing eller prolaps af folderne, hvilket resulterer i alvorlig MR. Papillarmuskel-dysfunktion på grund af ardannelse eller tilbagevendende iskæmi kan også føre til MR i de subakutte og kroniske faser efter MI; denne tilstand kan løse sig spontant.
Store posteriore infarkter giver akut MR på grund af asymmetrisk ringformet dilatation og ændret funktion og geometri af papillarmusklen.
Klinisk præsentation af MR
Patienter med funktionel mild eller moderat MR er ofte asymptomatiske. Sværhedsgraden af symptomerne varierer afhængigt af ventrikelfunktionen. Kliniske træk ved akut alvorlig MR omfatter åndenød, træthed, et nyt apikalt holosystolisk murren, flash-pulmonalt ødem og shock.
Det nye systoliske murren kan kun være tidlig- til midtsystolisk, ikke holosystolisk. Den kan være blød eller endog fraværende på grund af den pludselige stigning i venstre atrialtryk, som mindsker trykgradienten mellem venstre atrium og LV i forhold til kronisk MR. Mislyden høres bedst ved apex snarere end ved den nederste venstre sternalgrænse, og den er sjældent forbundet med en thrill. Der forventes S3- og S4-gallop.
Diagnose af MR
Klinikeren kan ikke stole på en ny holosystolisk murren til at diagnosticere MR eller vurdere dens sværhedsgrad på grund af den variable hæmodynamiske status. Hos en patient med AMI, der præsenterer sig med en ny apikal systolisk murren, akut lungeødem og kardiogent shock, er et højt indeks for klinisk mistanke om alvorlig MR nøglen til diagnosen.
Radiografi af brystkassen kan vise tegn på lungeødem i den akutte situation uden klinisk signifikant hjerteforstørrelse.
Ekokardiografi med farveflowdopplerafbildning er det diagnostiske standardværktøj til påvisning af MR. Transthorakal ekkokardiografi er det foretrukne indledende screeningsredskab, men transøsofageal ekkokardiografi er uvurderlig til at definere sværhedsgraden og den nøjagtige mekanisme af akut MR, især når mistanken om papillærmuskelruptur er høj. Der bør udføres hjertekateterisation hos alle patienter for at bestemme omfanget og sværhedsgraden af koronararteriesygdom.
Behandling af MR
Bestemmelse af hæmodynamisk stabilitet, klarlæggelse af den nøjagtige mekanisme ved akut MR og hurtig behandling er alle nødvendige for et gunstigt resultat. Medicinsk behandling omfatter afterload-reduktion med brug af diuretika, natriumnitroprussid og nitrater hos patienter, der ikke er hypotensive.
I patienter, der har hæmodynamisk kompromittering, bør intra-aortisk balloncounterpulsation hurtigt sættes ind. Dette indgreb reducerer normalt efterbelastningen og det regurgitative volumen betydeligt, hvilket forbedrer hjertets output som forberedelse til kirurgisk reparation. Uden kirurgisk reparation resulterer medicinsk behandling alene hos patienter med papillærmuskelruptur i utilstrækkelig hæmodynamisk forbedring og en dårlig prognose på kort sigt.
En akut kirurgisk indgreb er den foretrukne behandling af papillærmuskelruptur. Kirurgiske tilgange kan omfatte mitralklappereparation eller udskiftning. I fravær af papillarmuskelnekrose forbedrer mitralklappereparation overlevelsesraten mere end mitralklapudskiftning. Denne forskel skyldes, at det subvalvulære apparat normalt er bevaret. Mitralklapreparation eliminerer også komplikationer i forbindelse med fejlfunktion af protesen.
I patienter med omfattende nekrose af papillarmuskel og/eller ventrikulær fri væg er mitralklapudskiftning den foretrukne fremgangsmåde. Koronar bypass-transplantation (CABG) udført på operationstidspunktet blev i en undersøgelse vist at forbedre overlevelsen på kort og lang sigt.
Den eneste situation, hvor akut kirurgi med sikkerhed kan undgås, er i tilfælde af intermitterende MR på grund af tilbagevendende iskæmi. Hos disse patienter kan en vellykket myokardial revaskularisering være effektiv. Denne procedure udføres enten ved hjælp af angioplastik eller koronar bypass-transplantation.
Dynamisk LVOTO
Originalt troede man, at den kun var til stede ved hypertrofisk kardiomyopati, men forskellige investigatorer har rapporteret om tilstedeværelsen af dynamisk LVOTO som en komplikation ved akut anterior MI. Tilstedeværelsen af dynamisk LVOTO er også blevet postuleret som en af ætiologierne for myokardiebrud.
Dynamisk LVOTO er mekanisk forårsaget af kompenserende hyperkinesi af LV’s basale og midterste segmenter hos patienter med distale LAD-infarkter. Prædiktorer for forbedret regional vægbevægelse i ikke-infarktzoner er fravær af multikarsygdom, kvindelig køn og højere flow i det infarktrelaterede kar. Den øgede kontraktile kraft i det basale myokardium forårsager mitral regurgitation via Venturi-effekten. Dette resulterer i øget OTO, hvilket fører til yderligere nedsættelse af LV-output i forbindelse med allerede eksisterende systemisk hypoperfusion.
Denne øgede LVOTO i forbindelse med beskadiget transmuralt myokardium danner en perfekt ramme, hvor der er øget end-systolisk intraventrikulært tryk, hvilket inducerer øget vægstress i den svækkede, nekrotiske infarktzone. Denne ofte dødelige komplikation forekommer oftest hos kvinder, ældre patienter (>70 år) og patienter uden tidligere MI.
Klinisk præsentation af LVOTO
Den ramte patient kan have de sædvanlige symptomer på et forhøjet autonomt symptomkompleks såsom åndedrætsbesvær, diaphorese og kolde, klamme ekstremiteter, ud over de typiske tegn og symptomer på AMI.
Disse patienter kan hurtigt udvikle sig til kardiogent shock med alvorlig ortopnø, dyspnø og oliguri, og de kan have ændret mental status på grund af cerebral hypoperfusion. Patienterne kan præsentere sig med en ny systolisk ejektionsmurren, en ny holosystolisk murren, der udstråler til axillaen som følge af systolisk anterior bevægelse (SAM) af mitralbladet. Der kan også forekomme S3-gallop, lungerytmer, hypotension og takykardi; disse sidstnævnte fysiske tegn kan være helt fraværende i den akutte situation.
Enten transthorakal eller transøsofageal ekkokardiografi (TTE/TEE) er den foretrukne diagnostiske test og kan præcist karakterisere det hyperkinetiske segment, LVOTO og mitralbladets SAM.
Behandling af LVOTO
Overvej at reducere myokardiets hyperkontraktilitet ved at anvende forsigtig tilsætning af betablokade. Også langsom volumenresuscitering ved efterbelastningsforøgelse (phenylepherin) kan øge preload og mindske LVOTO og SAM. Det vil være bedst at undgå efterbelastningsforstærkende medicinering. Vasodilatorer, inotrope midler og ballonpumper bør også undgås, da de kan øge LVOTO.
RV-svigt
Ofte ses i forbindelse med inferior MI, post-MI mild RV-dysfunktion er almindelig; i de fleste tilfælde er virkningen på LV dog minimal.
Signifikant RV-hypokinese opstår, når der er proximal højre koronararterieokklusion med ringe kollateral fra den venstresidige cirkulation. Det postuleres, at fordi RV er tyndvægget og har et lavere iltbehov, er der koronar perfusion under hele hjertecyklussen; derfor er udbredt irreversibel infarkt sjældent.
Typisk RV-svigt kan vise sig med hypotension (på grund af manglende LV-preload) og jugularvenøs distension med et klart lungefelt. Selv om den klassisk er beskrevet i forbindelse med RV-svigt, ses denne triade sjældent i sin rene form i klinisk sammenhæng. De fleste patienter præsenterer sig med lavt kardiogent chok eller LV-svigt med tilhørende autonome symptomer.
Anstedeværelsen af jugularvenetryk over 8 cm H2O og Kussmaul-tegn er meget sensitiv og specifik for alvorligt RV-svigt.
I lejlighedsvis forårsager højre-venstre-shunt via et patent foramen ovale vedvarende hypoxæmi. Husk denne ejendommelige komplikation.
Elektrokardiografisk præsenterer patienterne sig med inferior ST-elevation sammen med ST-elevation i V4R-afledningen. Thoraxrøntgenbilledet ser normalt intetsigende ud, uden at der er nogen venøs distension i de øvre lober.
Diagnose af RV-svigt
To-dimensionel (2D) ekkokardiografi og magnetisk resonansbilleddannelse (MRI) er meget nyttige. Oftest vil ekkokardiografi være med til at fastslå diagnosen.
Swan-Ganz-kateteriseringsfund tyder normalt på høje RA-tryk med et lavt PCWP.
Behandling af RV-svigt
Volumeoplivning for at holde PCWP på eller omkring 15 mmHg kan hjælpe med at temporisere ved at øge RV-preloadet forbigående. Den endelige behandling omfatter dog genetablering af den koronare cirkulation. I sjældne tilfælde af alvorlig RV-svigt bør man overveje mekanisk cirkulationsstøtte ved hjælp af RV-assistentsystemer (AD) enten midlertidigt eller som brobehandling i forbindelse med omfattende biventrikulær involvering.