Klinisk journal
To patienter med ornithin-transcarbamylasemangel, en urinstofcyklusforstyrrelse, blev overført til vores intensivafdeling inden for 12 måneder. Begge var tidligere raske mænd, der oprindeligt præsenterede sig med ubeskrevne, men progressive neurologiske symptomer efter mindre indgreb (case summaries i boks 1).
Hver patient udviklede deres første neurologiske symptomer (hovedpine, mental langsomhed, inkoordination) omkring 24-48 timer efter den sandsynlige udløser, som i hvert tilfælde var en enkelt dosis af et kortikosteroid. Hos patient 1 udviklede søvnighed efter 48 timer sig til inkohærens, sløret syn og alvorlig agitation, der krævede intubation 2 dage senere. Hos patient 2 udviklede hovedpine, kvalme, sløret syn og epigastriske smerter efter 48 timer sig i løbet af de følgende 2 dage til forvirring og langsom tale; dagen efter var der opstået koma, som krævede intubation.
Da de blev indlagt på et perifert hospital, blev der foretaget et omfattende panel af patologiske undersøgelser for hver patient, herunder blodprøver (komplet blodtælling, nyrefunktionstest, leverenzymniveauer, koagulationsprofil og inflammatoriske markører), lumbalpunktur og hjerneafbildning (computertomografi og magnetisk resonansbilleddannelse). Resultaterne af disse undersøgelser var alle ubeskrivelige.
Identificering af betydelig hyperammonæmi blev forsinket indtil ca. 36-48 timer efter indlæggelsen på hospitalet. Patienterne var komatøse, da de blev overført til vores hospital. Patient 1 havde et længerevarende ophold på vores intensivafdeling med en vedvarende minimalt bevidst tilstand; Patient 2 gik videre til hjernedød og organdonation.
Læger vil være bekendt med de mest almindelige årsager til hyperammonæmi, herunder en øget proteinbelastning i forbindelse med leversygdom og urinstofcyklusenzymdysfunktion forårsaget af medicin som f.eks. natriumvalproat. Mindre almindelige, men vigtige årsager til forhøjede ammoniakniveauer i blodet er de arvelige urinstofcyklusforstyrrelser (UCD’er). De mest alvorlige former viser sig tidligt i livet, men mildere former af disse lidelser kan vise sig i voksenalderen.
UCD’er er en gruppe af medfødte fejl i stofskiftet med en anslået samlet forekomst på mellem 1:80001 og 1:30 0002 fødsler. De skyldes dysfunktion af et af de seks enzymer eller to transportproteiner, der er involveret i urinstofbiosyntesen, en proces, der overvejende finder sted i leveren. Urinstofcyklussen er den endelige vej til bortskaffelse af ammoniak, der dannes under aminosyrekatabolismen. Ammoniak er neurotoksisk, og enhver akut stigning i blodniveauet på over 50 μmol/L kan forårsage neurologiske symptomer. Mens ammoniakniveauer over 100 μmol/L kan forårsage obtundation, bør mildere forhøjelser fortolkes inden for den kliniske kontekst af deres forekomst.
Den UCD, der ramte vores to patienter, var ornithin-transcarbamylase (OTC)-mangel, den mest almindelige af urinstofcyklusforstyrrelserne. OTC-mangel er et X-bundet træk og kommer derfor hyppigst til udtryk hos mænd, selv om kvindelige bærere kan dekompensere efter en betydelig stress, f.eks. en fødsel.3 De andre UCD’er er autosomalt recessive træk.4
Den første præsentation i voksenalderen kan tilskrives den mildere grad af manglen og ofte også selvbegrænsning af proteinindtaget som en indlært adfærd, der muliggør stabilitet, indtil en miljømæssig stressfaktor indtræder. Tilstande, der fører til øgede krav til urinstofcyklusen, såsom proteinbelastning, infektion, systemiske kortikosteroider, hurtigt vægttab, kirurgi, traumer og kemoterapi5 , kan alle fremskynde dekompensation hos personer med UCD. Tilfældet med en 44-årig mand, der døde af en tidligere udiagnosticeret OTC-mangel efter koronar bypass-kirurgi, blev rapporteret i dette tidsskrift i 2007.6
I de to patienter, der er beskrevet i vores artikel, var en enkelt, men betydelig tilfældig dosis kortikosteroid den indledende udløsende begivenhed, hvor langvarig faste forevigede en ondartet metabolisk cyklus, der kulminerede i alvorlig hyperammonæmi.
Hyperammonæmi hos voksne kan vise sig med psykiatriske eller neurologiske symptomer, herunder hovedpine, forvirring, agitation med kamplystne adfærd, dysartri, ataksi, hallucinationer og synsforstyrrelser,3 symptomer, der afspejler toksisk metabolisk encephalopati. Abdominale symptomer (kvalme, opkastninger) kan ledsage fænomenerne i nervesystemet.
Vores to tilfælde illustrerer forløbet af progressiv hyperammonæmi, hvis behandlingen ikke iværksættes tidligt: forværring af kognitiv svækkelse og cerebralt ødem med udvikling af koma, kramper og død som følge af intrakraniel hypertension.
Når der ikke er nogen alternativ forklaring på den uforholdsmæssigt store og progressive karakter af en patients kognitive forstyrrelser, bør dette tages som et vigtigt signal til at undersøge muligheden for en metabolisk ætiologi. Da tilbagegangen sker over en periode på flere dage, er der et vindue for livreddende indgreb, hvis tilstanden erkendes i tide.
Måling af ammoniakniveauet i blodet som en del af en metabolisk screening bør i et sådant tilfælde foretages ved den tidligst mulige lejlighed. Hvis ammoniakniveauet er forhøjet, bør en metabolisk specialist konsulteres, en plasmaaminosyreprofil udarbejdes, organiske syrer og orotesyre i urinen måles, og der bør iværksættes akut behandling for hyperammonæmi.
De tre elementer i behandlingen af et hyperammonæmisk koma, der er knyttet til urinstofcyklus, omfatter:
-
fysisk fjernelse af ammoniak ved hæmodialyse eller hæmodiafiltrering;
-
omvendelse af den kataboliske tilstand ved insulin/dextrose og intralipidinfusion; og
-
midlertidig tilbageholdelse af protein og påbegyndelse af kvælstoffjernere, når de er tilgængelige.
Disse foranstaltninger bør iværksættes under vejledning af en metabolisk læge og på en intensivafdeling, hvor agitation eller koma kan håndteres. Ammoniakniveauet kan hurtigt reduceres ved dialyse; fjernelse af ammoniak er afhængig af flowhastigheden, hvilket gør intermitterende hæmodialyse til den mest effektive metode til clearance, som vist i boks 2. Af denne grund anbefaler vi intermitterende dialyse snarere end kontinuerlig venøs hæmodiafiltrering til tidlig ammoniakkontrol i akutte situationer.
Selv om alvorlig neurologisk svækkelse i starten af behandlingen er meget bekymrende, bør dette ikke i sig selv være en grund til at tilbageholde behandlingen, da en god neurologisk genopretning er mulig. Dette illustreres af caserapporten om en midaldrende patient, der kom sig, på trods af decorticate positur, da behandlingen blev indledt.5
Vi anbefaler en tidlig vurdering af ammoniakniveauet hos patienter med en uforklarlig ændret bevidsthedstilstand, eller når deres kognitive forstyrrelser synes ude af proportioner med en eventuel samtidig systemisk sygdom. Mange af de nødvendige elementer i behandlingen kan iværksættes på ikke-tertiære intensivafdelinger. Det er vigtigt at påbegynde behandlingen på hospitalet, hvor patienten præsenteres, da der er tale om en medicinsk nødsituation; det neurologiske resultat og overlevelsen afhænger i høj grad af tidspunktet for indgrebet. Hvis det erkendes tidligt og behandles hensigtsmæssigt, er prognosen for neurologisk helbredelse god.
Lærdom til praksis
-
Ureacyklusforstyrrelser kan først optræde i voksenalderen og afsløres af udløsende faktorer såsom systemisk sygdom, øget proteinbelastning, kirurgi eller kortikosteroider.
-
Vurdering af ammoniakniveauet er en enkel, men kritisk test hos patienter med uforklarlig bevidsthedssvækkelse.
-
En session med intermitterende hæmodialyse er meget effektiv til hurtig ammoniakkontrol og overlegen kontinuerlig hæmodiafiltrering til hurtig korrektion.
-
Nødbehandling af hyperammonæmi bør iværksættes tidligt for at forhindre ødelæggende neurologiske skader.
Kasse 1 – Case historier for de to patienter
Patient 1: 24 år, mand
Medicinsk anamnese
- Obstruktiv søvnapnø; ingen bemærkelsesværdig familieanamnese; højtfungerende person
- Sandsynlig udløbsårsag: intraoperativ dexamethason (8 mg) under nasal septoplastik
Forløb
- Vaghed og sløvhed 48 timer efter operationen, udviklede sig over 24 timer til inkoherens
- Intuberet 12 timer senere på grund af alvorlig agitation
- GCS faldt til 5-6 i løbet af de næste 48 timer; ammoniakniveau, 334 μmol/L (RR, < 50 μmol/L); sygdomsspecifik behandling påbegyndt
- Stige intrakranielle tryk 6 timer senere (dilaterede pupiller med cerebralt ødem på CT hjerne), hvilket førte til dekompressiv kraniektomi kompliceret af frontalt hæmatom, krævede evakuering
- Langvarig intensivafdeling og hospitalsophold
Udgang
- Persisterende minimalt bevidst tilstand (ved 22 måneder)
- Udskrives til plejehjem
- Biokemisk analyse af plasma og urin stemmer overens med OTC-mangel (forhøjet orotisk syre i urinen; højt niveau af plasmaglutamin; lavt niveau af ornithin, citrullin og arginin i plasma)
- Genetisk test bekræftede OTC-genmutation, der er forbundet med OTC-mangel
Patient 2: 39 år gammel, mand
Medicinsk anamnese
- Chroniske knæsmerter; ingen bemærkelsesværdig familiehistorie; højtfungerende person
- Sandsynlig udløbsfaktor: kortisoninjektion i knæet for knæsmerter
Forløb
- Hovedpine, kvalme, epigastriske smerter, sløret syn og inkoordination 48 timer efter injektion
- Fremskreden i løbet af de næste 48 timer til forvirring, langsom tale
- Progressivt fald i GCS, der krævede intubation
- Krampeanfaldsaktivitet
- Gentagelse af CT af hjernen viste cerebralt ødem
- Ammoniakniveau: 652 μmol/L (RR, < 50 μmol/L); sygdomsspecifik behandling påbegyndt; intrakraniel trykmonitor indsat; manglende kontrol af intrakraniel hypertension; beslutning om palliation
Outcome
- Fortsat til hjernedød og organdonation (undtagen leverdonation: kontraindiceret)
- Biokemiske fund, der er i overensstemmelse med OTC-mangel (kraftig forhøjelse af orotisk syre i urinen, højt glutaminniveau i plasma, lavt argininniveau)
- Genetisk test bekræftede OTC-genmutation, der er forbundet med OTC-mangel
GCS = Glasgow coma score; RR = referenceinterval; CT = computertomografi; OTC = ornithintranscarbamylase.
Kasse 2 – Ammoniakniveauer hos vores to patienter og deres respons på behandling*
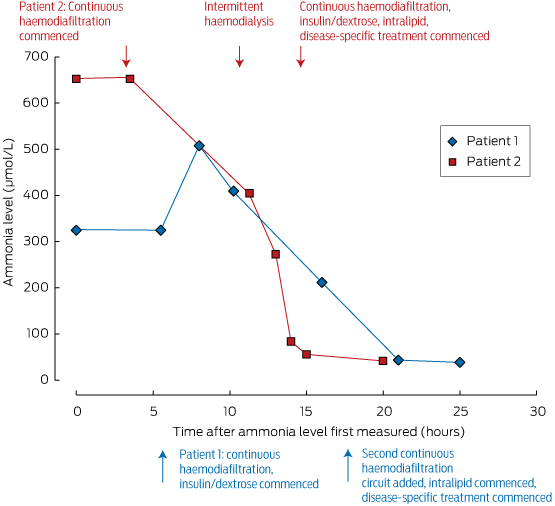
* Bemærk det hurtige fald i serumammoniakniveauet hos patient 2, der blev opnået efter påbegyndelse af intermitterende hæmodialyse (ca. 10 timer efter første måling).