Guanosintrifosfat (Guanosin-5′-triphosphat for at være præcis eller også almindeligvis forkortet GTP for enkelhedens skyld) er et højenerginukleotid (ikke at forveksle med nukleosid), der findes i cytoplasmaet eller er polymeriseret for at danne guaninbasen.
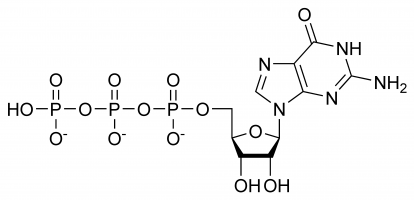
GTP har selektive roller i dannelsen af RNA-strenge, fungerer som et energibærermolekyle til proteinsyntese, et coenzym, en forløber for cGMP – et sekundært budbringermolekyle eller som et effektormolekyle. De to sidste påvises almindeligvis ved G-proteinmodulation. Alle disse er et resultat af dets komplekse tredimensionelle struktur og de mange forskellige kemiske grupper, som det består af. For enkelhedens skyld kan man derfor betragte det som et sammensurium af forskellige funktionelle grupper, der praktisk talt udfører forskellige funktioner isoleret set (selv om strukturen til tider vil være involveret, f.eks. når det interagerer med et enzym og et andet substrat), f.eks. er kun triphosphatet involveret i frigivelsen af energi til polymerisation, mens kun guaninbasen er involveret i dets deaminering. Det er vigtigt at bemærke, at den liste, der blev givet i begyndelsen, ikke viser alle de kemiske interaktioner, men blot er en demonstration af dens forskellige muligheder.
I GTP er ribosesukkeret centralt i det tredimensionelle arrangement af de kovalent bundne guanin- og triphosphatmolekyler. Dette monosakkarid giver hydroxylgrupper til kondensationsreaktioner og nukleofile angreb, hvoraf sidstnævnte er vigtigt for ødelæggelsen af RNA-molekyler og dermed for reguleringen af genekspressionen. Guaninmolekylet og triphosphatet danner kovalente bindinger ved henholdsvis C’1- og C’5-atomer, men det er også muligt for dem at udnytte andre hydroxylgrupper, så længe den resulterende struktur ikke giver anledning til sammenstød. Set fra purinets synsvinkel er det bundet som følge af en kondensationsreaktion ved dets 9’N, som tidligere var kovalent bundet til et hydrogenatom. Da guanin er en purinbase, klassificeres det som et purintrifosfat sammen med adenintrifosfat (ATP) og dannes gennem inosinmonofosfatmodifikation.
Indhold
- 1 Misforståelse: GTP, en grundlæggende byggesten
- 2 En af mange RNA-baseprædecesorer
- 3 GTP; en fætter til universal ATP
- 4 En ressource til signalering
- 5 Referencer
Misforståelse: GTP, en grundlæggende byggesten
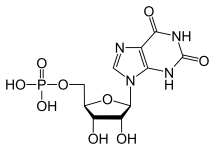
Leveren er det vigtigste organ, der syntetiserer purin- og pyramidinnukleotider. Purinnukleotider (GTP og ATP) syntetiseres ved først at skabe inosinmonofosfat ud fra ATP, glutamin, glycin, CO2, aspartat og format. IMP
kan derefter modificeres til at give et af de to molekyler.
I tilfælde af GTP-dannelse omdannes IMP først til XMP af IMP-dehydrogenase. Den resulterende kemiske og strukturelle ændring muliggør virkningen af GTP-syntase, som hurtigt omdanner XMP til GMP. GMP er imidlertid ikke et højenergimolekyle, da det ikke har en triphosphat, så det fosforyleres derefter af nukleosidphosphatkinaser for først at give en difosfat og til sidst en triphosphat.
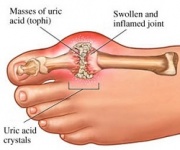
GTP kataboliseres normalt til uopløselig urinsyre, som derefter kan forekomme i urinen som natriumuratkrystaller. Denne proces betragtes som unormal, hvis den finder sted i synovialleddene og resulterer i urinsyre, som derefter omdannes til skadeligt mononatriumurat eller kalciumpyrofosfatdihydrat. Tilstedeværelsen af sådanne kemikalier giver mulighed for udvikling af inflammation og gigt, og de kombinerede symptomer fører til, at sygdommen klassificeres som gigt. Et andet eksempel på vigtigheden af en passende purinnukleotidkatabolisme er Severe Combined Immunodeficiency Disease, som resulterer i ødelæggelse af vigtige B- og T-lymfocytter
One Of Many RNA Base Predecesors
Der er adskillige forskelle mellem RNA og DNA, men den primære forskel ligger i strukturen af de nukleobaser, der opbygger hver enkelt polymer. RNA-nukleobaser indeholder en 2’OH-gruppe på deres ribosesukker, hvilket gør dem betydeligt mere kemisk reaktive, katalytiske og ustabile. Det er vigtigt at bemærke, at guanosintrifosfat kun beskæftiger sig med fremstillingen af guaninbasen i RNA. Analogt til GTP til dannelse af en guaninbase i DNA er deoxyguanosintrifosfat. Dette triphosphat indeholder et deoxyribose-sukker uden en
2’OH-gruppe, hvilket gør det betydeligt mere stabilt – det forhindrer nukleofile angreb, som ville spalte fosfodiesterbindingerne mellem nukleobaserne. Dette er ideelt, da RNA skal opløses, efter at det er blevet oversat til et protein, mens DNA skal forblive intakt med henblik på overførslen af genetisk information til dattercellen.
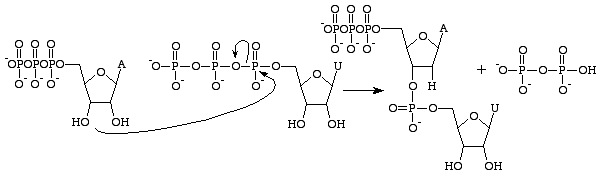
Guanosintrifosfat vil resultere i dannelsen af en guaninbase som følge af spaltning af en anhydridbinding og frigivelse af alfa- og gammafosfater som frie fosfater. GMP vil derefter danne en phosphodiesterbinding med den nærliggende base, der indeholder en 3’OH-gruppe, og levere en 3’OH-gruppe til den næste RNA-base. Denne reaktion finder kun sted, hvis den modsatte base til GMP er cytosin, som den kan danne hydrogenbindinger med, og hvis hastighed øges af RNA-polymerase. RNA-polymerase tilpasser ikke triphosphaterne. Det katalyserer blot den reaktion, der finder sted, efter at dette er sket uafhængigt af hinanden. Efter katalysen er molekylet en del af en polynukleotidkæde og er ikke længere kendt som GTP, men som basen guanin.
GTP; en fætter til universel ATP
Den underliggende mekanisme for energiudnyttelse fra spaltning af anhydridbindinger er den samme i alle triphosphater. Triphosphaternes høje energistatus opnås gennem tre forskellige mekanismer. Den første skyldes de repulsive kræfter
på hver af fosfatgrupperne. Dette bidrager til en høj ustabilitet af de bundne triphosphater og et stort “ønske” om at opnå en lavere energistatus. Den anden skyldes resonansstabilisering. Når GTP
omdannes til GDP, øges mængden af mulige positioner for de eksisterende elektronpar, hvilket giver en større stabilitet. Dette argument bekræftes også ved omdannelse af GDP til GMP. Det tredje skyldes den ugunstige entropiske virkning, som en øget mængde fosfater har på konformationen af de vandmolekyler, der omgiver molekylet.
Da GTP-koncentrationen i cytoplasmaet er betydeligt lavere end ATP-koncentrationen, anvendes det til specifikke funktioner i cellens metaboliske processer.
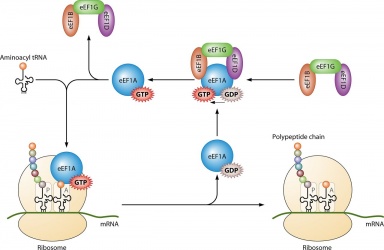
Dets vigtigste anvendelse er i proteinsyntesen, når det er koblet med IF2 under ribosomal initiering, Ef-Tu og Ef-G under forlængelsen og ;RF3 under termineringen. Alle GTP-molekyler, der bindes med de nævnte proteiner, bliver affosforyleret, hvilket resulterer i GDP og et frit fosfat
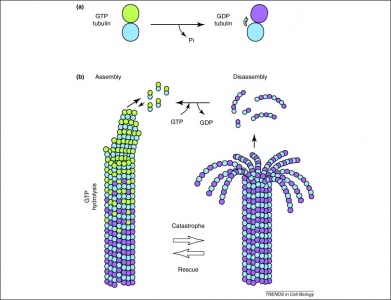
Dertil kommer, at GTP også udnyttes af tubulindimere i deres dannelse af mikrotubuli. Tubulindimerer består af alfa- og betatubulin, som hver især har GTP-bindingssteder. Da betatubulin findes i den positive ende af filamentet, hydrolyseres GTP altid her, når endnu en dimer tilføjes til den forlængede polymer. Det er vigtigt, at hydrolysen af GTP svækker de ikke-kovalente interaktioner mellem tubulindimere, hvilket gør det lettere for dem at opløse mikrotubuli, når det er nødvendigt. Bemærk, at alfa-tubulinproteinet GTP ikke er affosforyleret, så det kan anses for at være konsistent i hele mikrotubuli-strukturen.
En ressource til signalering
Anvendelsen af GTP’s specifikke kemi og rumlige konformation demonstreres effektivt ved dets anvendelse til signaloverførsel. Primært er det i stand til at binde og regulere aktiviteten af forskellige signalvejsproteiner, som er klassificeret i to forskellige grupper. Den første gruppe er heterotrimeriske GTP-bindingsproteiner (også kendt som heterotrimeriske G-proteiner), som ved aktivering af G-proteinkoblede receptorer anvender GTP til at ændre aktiviteten af andre proteiner i signalvejen … Den anden gruppe er monomere GTP-bindingsproteiner (også kendt som monomere G-proteiner). Disse reagerer på andre receptorer end G-proteinkoblede receptorer. Et typisk eksempel, der nævnes i deres forklaring, er Ras-proteinet. Bemærk, at de er i stand til selektivt at binde GTP bikke kun på grund af dets specifikke kemi, men også på grund af det inducerede pasningsfænomen. Den bundne GTP vil derefter blive hydrolyseret efter et vist tidsrum og dermed resultere i en auto-inaktivering af proteinet og forebyggelse af overdreven stimulering af en signalvej. Når GTP er hydrolyseret, vil GDP forblive bundet, da konformationsændringen vil resultere i et skift i affinitet til GTP-molekylet og GDP-molekylet. Der er imidlertid tale om en uoprettelig ændring, som kan vendes ved efterfølgende aktivering af den G-proteinkoblede receptor.
GTP kan også bruges som en reaktant til at producere cGMP, som er et relativt almindeligt sekundært signalmolekyle. Katalysen udløses af frigivelse af NO, som aktiverer guanylatcyklase, et enzym, der producerer cGMP i form af GTP. cGMP kan derefter fungere som en effektor over for proteinkinaser, der fosforylerer og ændrer specifikke proteiners virkning.
- J Koolman og KH Roehm, Color Atlas of Biochemistry, 3. udgave, Stuttgart, Tyskland. Thieme 2013.
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell og P A Weil. Harper’s Illustrated Biochemistry (Harper’s illustreret biokemi). 28. udgave. Beijing, Kina. 2009.
- J Dow, G Lindsay og J Morrison, Biochemistry: Molekyler, celler og kroppen. 1st Edition. Wokingham, England. Addison-Wesley, England. 1996.
- J Dow, G Lindsay og J Morrison, Biochemistry: Molekyler, celler og kroppen. 1st Edition. Wokingham, England. Addison-Wesley, England. 1996.
- J Dow, G Lindsay og J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Koolman og KH Roehm, Color Atlas of Biochemistry, 3. udgave, Stuttgart, Tyskland. Thieme 2013.
- J Koolman og KH Roehm, Color Atlas of Biochemistry, 3. udgave, Stuttgart, Tyskland. Thieme 2013.
- M W King. Den medicinske biokemiside. September 2016. Citeret: 11:31. 03.12.2016. Tilgængelig fra: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell og P A Weil. Harper’s Illustrated Biochemistry. 28. udgave. Beijing, Kina. 2009.
- M W King. Den medicinske biokemiside. September 2016. Citeret: 11:31. 03.12.2016. Tilgængelig fra: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Den medicinske biokemiside. September 2016. Citeret: 11:31. 03.12.2016. Tilgængelig fra: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Den medicinske biokemiside. September 2016. Citeret: 11:31. 03.12.2016. Tilgængelig fra: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Den medicinske biokemiside. September 2016. Citeret: 11:31. 03.12.2016. Tilgængelig fra: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- J Dow, G Lindsay og J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Dow, G Lindsay og J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Dow, G Lindsay og J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Koolman og KH Roehm, Color Atlas of Biochemistry, 3. udgave, Stuttgart, Tyskland. Thieme 2013.
- J M Berg, J L Tymoczko, G J Gatto og R Stryer. Biochemistry. Ottende udgave. By og land Uidentificeret. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto og R Stryer. Biochemistry. Ottende udgave. By og land Uidentificeret. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto og R Stryer. Biochemistry. Ottende udgave. By og land Uidentificeret. Freeman and Co. 2015.
- T E Dever og R Green. Elongations-, terminerings- og genbrugsfaserne i Eukaryoter. CSHPB. Juli 2012. 4:7:1-16
- B Alberts et al. Molecular Biology of The Cell. 6th Edition. New York, USA. Garland Science. 2015.
- B Alberts. Molecular Biology of The Cell. 6th Edition. New York, USA. Garland Science. 2015.
- J Koolman og KH Roehm, Color Atlas of Biochemistry, 3. udgave, Stuttgart, Tyskland. Thieme 2013.
- J Koolman og KH Roehm, Color Atlas of Biochemistry, 3. udgave, Stuttgart, Tyskland. Thieme 2013.
- J Koolman og KH Roehm, Color Atlas of Biochemistry, 3. udgave, Stuttgart, Tyskland. Thieme 2013.
- J Koolman og KH Roehm, Color Atlas of Biochemistry, 3. udgave, Stuttgart, Tyskland. Thieme 2013.