- Introduktion: Det er blevet identificeret af den globale sygdomsbyrdeundersøgelse (GBD) 2016 som den sjette mest udbredte lidelse og en af de vigtigste årsager til invaliditet over hele verden, der ofte forekommer i den erhvervsaktive alder og hos unge voksne og midaldrende kvinder (Collaborators, 2018). Derfor udgør migræne et meget alvorligt socialt problem med hensyn til antal leveår med handicap (YLD) og den vigtigste årsag til YLD i alderen 15-49 år (se Steiner et al., 2018). Byrden af en sådan sygdom er ikke blevet identificeret før for nylig, fordi: migræne ikke er en årsag til permanent invaliditet eller død; hovedpine forekommer lejlighedsvis i den almindelige befolkning (Collaborators, 2018). Selv om man ikke kender en sikker patogenese for migræne, er det ekstrakranielle kredsløb involveret (Drummond og Lance, 1983). Det kliniske forløb af migræne er artikuleret i forskellige følgende eller samtidige faser: præmonitorisk, aura, hovedpine og postdrome (svarende til den præmonitoriske fase) (Goadsby et al., 2017a). Den præmonitoriske fase omfatter irritabilitet, madtrang, stiv nakke og kan forekomme fra 2 til 72 timer før anfaldet og fortsætter over de andre faser. I henhold til definitionerne i den internationale klassifikation af hovedpineforstyrrelser tredje udgave (ICHD-3):
- Patofysiologi af migræne og Calcitonin Gene-Related Peptide (CGRP)
- Farmakologiske interventioner på CGRP pathway
- Pharmakokinetik (PK)/Pharmakodynamik (PD)-forholdet mellem mAbs mod migræne
- Konklusion
- Author Contributions
- Interessekonflikter
– aura er karakteriseret ved et eller flere forbigående, reversible neurologiske underskud, hvoraf mindst ét skal have en unilateral lokalisering, der udvikler sig over 5 min eller mere, og hvoraf hvert underskud varer mellem 5 og 60 min;
– migræne består i hovedpineanfald, der varer 4-72 h ledsaget af kvalme, fotofobi og fonofobi eller begge dele (se Goadsby et al., 2017a).
Kutan allodyni, defineret som opfattelsen af smerte efter ikke-smertefulde stimuli, forekommer hos mere end de 70 % af patienterne (Lambru et al., 2018). Alvorlig hovedpine aftager til ophør i postdromefasen, mens andre symptomer såsom astheni, somnolens og fotofobi bliver ved med at påvirke patienten, hvilket viser det komplekse neurale grundlag, der ligger til grund for migræne (Lambru et al., 2018). Afhængigt af antallet af dage pr. måned, der påvirkes, klassificeres migræne som episodisk (færre end 15 migræne- eller hovedpinedage) eller kronisk (mindst 15 dage, hvoraf 8 eller flere er migrænedage) (se Goadsby et al., 2017b). Dette aspekt påvirker i bemærkelsesværdig grad sygdommens indvirkning og de terapeutiske muligheder (Giamberardino et al., 2017). Ved 1 til 3 anfald om måneden er det muligt kun at anvende abortive symptomatiske lægemidler, mens det ved 4 til 14 anfald om måneden er obligatorisk at tilføje forebyggende behandlinger; sidstnævnte behandlinger er nødvendige for at undgå kronificering af sygdommen (Giamberardino og Martelletti, 2015; Giamberardino et al, 2017) og for at reducere risikoen for hovedpine ved overforbrug af medicin og refraktær migræne (Martelletti, 2017).
Patofysiologi af migræne og Calcitonin Gene-Related Peptide (CGRP)
Den nøjagtige årsag til migræneanfald er endnu ikke velkendt, men den aktuelle forskning har fremhævet betydningen af sensibiliseringsprocesser i det trigeminovaskulære system og hele hjernestammen, samt observationen af reduceret gråt stof i smertebehandlingsområder (se Goadsby et al, 2017a). Fra det trigeminale ganglion, der indeholder cellekroppen, synapser pseudo-unipolære primære afferenter på blodkarrene og på det trigeminocervikale kompleks, hvorfra fibre af anden orden synapser på thalamocortikale neuroner af tredje orden og på locus coeruleus, periaqueductal grå og hypothalamus (Goadsby et al., 2017a). De nociceptive fibre fra det trigeminale ganglion og de cervikale dorsalrodsganglier innerverer dura mater-karrene, og deres terminaler frigiver vasoaktive neuropeptider såsom calcitonin genrelateret peptid (CGRP), der inducerer vasodilatation. Ekspression af CGRP, CLR og RAMP1 i humane dura mater-kar er vist i figur 1A-C. Faktisk indeholder de autonome nervøse fibre, der innerverer ekstracerebrale vaskulaturer, flere vasoaktive neurotransmittermolekyler: noradrenalin, serotonin, acetylcholin, neuropeptid Y (NPY), vasoaktivt tarmpolypeptid (VIP), substans P (SP), neurokinin A (NU) og CGRP (Goadsby et al., 1990). CGRP-receptorantagonisterne virker blokerende på den nociceptive information fra dura mater: den behandles i de thalamiske kerner, hvorfra den når højere kortikale regioner. Disse input fra det trigeminovaskulære system moduleres af den nedadgående vej fra hjernestammen: 5-hydroxytryptamin (5HT)1B/1D-receptoragonisterne, dvs. triptaner, menes at virke via dette system og modvirke den opståede vasodilatation. Mens propranolol og topiramat anvendes som forebyggende behandling, anvendes sidstnævnte lægemidler ved akutte migræneepisoder. Ud over deres vasokonstriktoriske aktivitet hæmmer triptaner, der virker direkte på 5HT1B/D-præsynaptiske receptorer, frigivelsen af mediatorer som CGRP, der er involveret i nociception. Desuden er det eksperimentelt blevet påvist, at sumatriptan hæmmer den indadgående strøm, der formidles af transient receptor potential vanilloid 1 (TRPV1) i de trigeminale ganglier (Evans et al., 2012). CGRP frigives under migræneanfald, og det viser flere roller som det mest vasoaktive neuropeptid, hvis kraniovaskulære niveauer stiger i løbet af sygdommen (Goadsby et al., 1990). Det er blevet vist, at CGRP også undergår ændringer i cerebrospinalvæske (van Dongen et al., 2017). De udløsende faktorer til ændret central excitabilitet og det efterfølgende gennembrud af migrænesmerteepisoder er længe blevet undersøgt. Stimulering af nervefibre kan fremme både ortodromiske og antidromiske aktionspotentialer, og især aktivering af durale peptidergiske primære sensoriske afferenter, der udtrykker det transiente receptorpotentiale (TRP), kan inducere frigivelse af flere molekyler, herunder CGRP, som udløser inflammatoriske vævsreaktioner, der er kendt som neurogen inflammation (Xanthos og Sandkuhler, 2014). CGRP er især involveret i kraniel nociception og i epifænomenet vasodilation, der binder sine receptorer på meningeale og cerebrale blodkar (Deen et al., 2017). Disse processer fremmer sensibiliseringen af de trigeminusfibre af anden orden, der tager forstærkede smertefulde stimuli til højere regioner som thalamus, hypothalamus og cortex, hvilket giver anledning til migræne (Dussor et al., 2014). TRP’er aktiveres som reaktion på flere irriterende miljømæssige stimuli som temperatur- og pH-variationer, der hos prædisponerede personer kan udløse migrænesmerter. CGRP produceres ved vævsspecifik alternativ splejsning af calcitonin-genet CALC I på kromosom 11, som også koder for calcitonin. Derimod produceres β CGRP fra CALC II-genet, der er placeret på et andet sted på kromosom 11. α CGRP-neuropeptidet findes i centralnervesystemet som α-isoform på 37 aminosyrer, og dets signaltransduktion formidles af to receptorer.
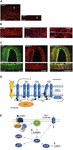
Figur 1. CGRP-forekomst og -vej i forbindelse med migræne. Ekspression af CGRP, CLR og RAMP1 i menneskelige dura-kar: (A) CGRP-immunoreaktivitet findes i tynde fibre i adventitien; (B) tvær- og længdesnit, der viser RAMP1-ekspression i cytoplasmaet af glatte muskelceller; (C) coekspression af CLR og RAMP1 i det glatte muskelcellelag. (D) CGRP-receptorkomponenter og vigtige rester for receptorsignalering og internalisering. CGRP-receptoren er dannet af CLR (blå), RAMP1 (gul) og RCP (orange). Funktionelt vigtige rester er vist som enkeltbogstavsforkortelser. Aminosyreresterne er nummereret fra starten af det forudsagte N-terminale signalpeptid (Swiss-Prot Q16602). Flere aminosyrer inden for CLR’s C-terminus (∼N400-C436) og I312 ved ICL3/TM5-knudepunktet er nødvendige for effektiv CGRP-medieret internalisering. Vigtige træk ved CGRP-receptoren, herunder TM6-“knækket” (P343) og den formodede ottende helix (∼G388-W399) i CLR, er illustreret. C′, C-terminal; ECL, ekstracellulær loop; ICL, intracellulær loop; N′, N-terminal; TM, transmembran. (E) CGRP-receptormedieret intracellulær signalering: Gαs-signalering øger AC-aktiviteten (grøn), hvilket øger den intracellulære cAMP, aktiverer PKA og efterfølgende mange potentielle downstream-effektorer. Panelerne (A-C) er tilpasset fra henholdsvis Eftekhari et al. (2013) og panel (D,E) fra Walker et al. (2010) med tilladelse.
Den første er kendt som den kanoniske CGRP-receptor og er en Gαs-protein-koblet receptor, som kræver det receptoraktivitetsmodificerende protein (RAMP) 1 for at være funktionel (Goadsby et al., 2017a). Den anden er den humane amylin subtype 1-receptor (AMY1): amylin tilhører calcitonin-genfamilien, og den har hormonel aktivitet. Når CGRP binder til sin receptor, underkastes det en dynamin/clathrin-afhængig internalisering efter at være blevet komplekseret med β-arrestin (se Walker et al., 2010). Der sker konformationsændringer, der inducerer aktivering af adenylatcyklase (AC), stigning i cAMP og aktivering af proteinkinase A (PKA), som kan fremme vasodilatation gennem direkte aktivering af endothelial nitrogenoxidsyntase og smertereaktioner. Sidstnævnte receptor kan kobles til Gαq/11 med aktivering af phospholipase C (PLC), til mitogen-aktiveret proteinkinase (MAPK) og til frigivelse af NO (se Walker et al., 2010) (se figur 1D,E for skematisk fremstilling af CGRP-receptormedieret intracellulær signalering). Indgivelse af CGRP til migrænepatienter udløser anfald, og disse beviser understøtter dets centrale rolle i patogenesen af migræne (Lassen et al., 2002). Et signalafslutningssystem er endnu ikke blevet identificeret: CGRP metaboliseres af neprilysin, insulinnedbrydende enzym og endothelin-konverterende enzym-1, og der er blevet opstillet en hypotese om et aktivt transportsystem til genoptagelse (se Russell et al., 2014). Desuden, når receptoren er forbigående aktiveret af CGRP, internaliseres den i endosomer og genbruges hurtigt tilbage til cellemembranen, mens kronisk stimulering af receptoren inducerer desensibilisering og lysosomal nedbrydning (se Russell et al, 2014).
Farmakologiske interventioner på CGRP pathway
Migræne er en multifacetteret invaliderende neurovaskulær lidelse, og den nuværende behandling med orale triptaner er effektiv i akutte anfald, selv om omkring 40 % af patienterne er resistente over for behandlingen (Ferrari et al., 2001; Edvinsson, 2015). Disse selektive 5-HT1B/1D-agonister, hvoraf den mest almindeligt anvendte er sumatriptan, der for det meste er aktiv til subkutan rute, udøver deres terapeutiske virkning gennem vasokonstriktion af kraniekar og hæmning af det trigeminale og trigeminocervikale system (se Ferrari et al., 2001). Vasokonstriktion udgør imidlertid en grænse for de kardiovaskulære bivirkninger af disse lægemidler. Desuden kan behandlingen med triptaner ikke vare længere end 9 dage om måneden på grund af risikoen for lægemiddelinduceret hovedpine. I 2010 blev botulinumtoksin type A (BoNT-A) godkendt af Food and Drug Administration (FDA) til forebyggelse af migræne hos kroniske migrænikere, der ikke reagerer, men den komplekse administration (det kræver injektion på 31 steder) begrænser patienternes compliance. På grund af den centrale rolle, som CGRP spiller i migrænens patofysiologi, er der blevet udviklet antagonister af dets receptor. Disse lægemidler hører til klassen af gepants. Telgecepant, det første orale gepant, blev godt tolereret hos migrænepatienter med koronararteriesygdom (ClinicalTrials.gov NCT00662818, Ho et al., 2012), men det gav hepatotoksicitet, og derfor blev der på trods af fortsat forskning i disse små molekyler foreslået en ny tilgang bestående i udvikling af monoklonale antistoffer (mAbs) mod CGRP (nezumabs) eller CGRP-receptoren (numabs). Disse lægemidler menes at hæmme virkningen af de cirkulerende CGRP-molekyler for at forebygge migræneanfald, og da de ikke krydser blod-hjernebarrieren (BBB) på grund af deres størrelse, skulle virkningsstederne være i det trigeminale system (Edvinsson, 2015). Især duralkar er ikke omfattet af BBB. Desuden krydser CGRP sandsynligvis ikke BBB og virker som en parakrin modulator, da det udtrykkes af halvdelen af neuronerne i trigeminusganglien, som ikke præsenterer CGRP-receptoren, udtrykt af satellitgliaceller og de 30% af neuronalsomaen i trigeminusganglien (se Yuan et al., 2017). I øjeblikket er der fire mAbs, eptinezumab, fremanezumab, galcanezumab og erenumab, der undersøges i kliniske forsøg til behandling af episodisk og kronisk migræne. De tre første mAbs er humaniserede antistoffer rettet mod CGRP, mens erenumab er et humant antistof mod dets canoniske receptor. Halveringstiden for disse lægemidler er ret lang, hvilket ikke muliggør mere end én indgift pr. måned, og dette er interessant, da mAbs skal administreres intravenøst eller subkutant. Især eptinezumab administreres kun intravenøst (Israel et al., 2018). I fase III PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) -forsøget (ClinicalTrials.gov NCT02559895) blev Eptinezumabs effektivitet vurderet med hensyn til forebyggelse af hyppig episodisk migræne. Resultaterne viste en signifikant reduktion af det primære endepunkt bestående af fald i månedlige migrænedage (MMD’er) fra en gennemsnitlig baseline på 8,5 dage over ugerne 1-12 til 4,3 MMD’er med dosis på 300 mg, 3,9 med 100 mg og 4,0 med 30 mg i forhold til 3,2 dage med placebo (Saper et al., 2018). Til evaluering af eptinezumab til forebyggelse af kronisk migræne er 1121 deltagere blevet indskrevet i PROMISE 2 (ClinicalTrials.gov NCT02974153). Galcanezumab blev vurderet for effektivitet til forebyggelse af episodisk migræne i EVOLVE-1 fase 3 dobbeltblind, randomiseret, placebokontrolleret undersøgelse (ClinicalTrials.gov NCT02614183) dissekeret i 4 perioder og i EVOLVE-2 fase 3 randomiseret kontrolleret dobbeltblind 6-måneders-klinisk forsøg (ClinicalTrials.gov NCT02614196). I EVOLVE-1-forsøget opfyldte begge doser af galcanezumab (120 og 240 mg) det primære resultat af en signifikant reduktion af antallet af månedlige migrænehovedpinedage på henholdsvis 4,7 dage og 4,6 dage sammenlignet med 2,8 dage for placebo (Stauffer et al., 2018). I EVOLVE-2 fik patienterne en månedlig injektion af 120 eller 240 mg galcanezumab. De gennemsnitlige månedlige migrænehovedpinedage blev reduceret med henholdsvis 4,3 og 4,2 dage sammenlignet med en reduktion på 2,3 dage opnået med placebo (p < 0,001) (Skljarevski et al., 2018) (Skljarevski et al., 2018). Også de sekundære endepunkter for reduktion af funktionel svækkelse vurderet ved hjælp af R-FR-score (Role Function-Restrictive) i det migrænespecifikke livskvalitetsspørgeskema (MSQ) og forbedring af scoren i Patient Global Impression of Severity (PGI-S) og i Migraine Disability Assessment (MIDAS; tidspunkt = 6. måned) blev opfyldt (Skljarevski et al., 2018). 147 (65,0 %) og 163 (71,5 %) af patienterne behandlet med galcanezumab, henholdsvis 120 og 240 mg, og 287 (62,3 %) med placebo præsenterede bivirkninger, blandt hvilke akut myokardieinfarkt og forbigående iskæmisk anfald inden for en gruppe på syv patienter under behandling med galcanezumab 240 mg (Skljarevski et al., 2018). Der var ikke statistisk signifikante forskelle i den gennemsnitlige ændring fra baseline for systolisk/diastolisk blodtryk. De 19 (8,6 %), 11 (5,1 %) og 2 (0,5 %) patienter i henholdsvis galcanezumab 120 mg-, galcanezumab 240 mg- og placebogrupperne viste behandlingsfremkaldende antistoffer mod lægemidler (ADA). I REGAIN fase III-forsøget til evaluering af galcanezumab mod kronisk migræne blev MMD’er reduceret med 4,8 dage med 120 mg-dosis og med 4,6 dage med 240 mg-dosis sammenlignet med 2,7 med placebo (se Yuan et al., 2017). Desuden blev det påvist, at behandlingen med galcanezumab var udstyret med statistisk signifikant persistens af effekten (Forderreuther et al., 2018). Fremanezumab blev undersøgt i fase III HALO-forsøget til forebyggende behandling af migræne (ClinicalTrials.gov NCT02638103). Det reducerede MMD’er af episodisk migræne efter 12 uger på 3,7 dage ved 225 mg månedligt i 3 måneder og på 3,4 dage ved 675 mg en gang i kvartalsvis dosisregime sammenlignet med faldet på 2,2 dage for placebo (se Yuan et al., 2017). Effektiviteten af erenumab i forebyggelse af episodisk migræne blev undersøgt i den fase 3, randomiserede, dobbeltblindede, placebokontrollerede undersøgelse ARISE (ClinicalTrials.gov NCT02483585). MMD’er blev reduceret ved 70 mg månedlig subkutan erenumab på 2,9 dage sammenlignet med 1,8 dage med placebo (p < 0,001), og det var effektivt i forhold til de sekundære endepunkter på mindst 50 % reduktion i MMD’er og ændring i månedlige migrænespecifikke medicineringsbehandlingsdage (MSMD) (Dodick et al., 2018). Andelen af patienter, der præsenterede bivirkninger, var ens mellem gruppen behandlet med mAb og placebo. 4,3 % testede positivt for antierenumab-bindende antistoffer gennem uge 12, hvoraf én af dem var forbigående positiv for neutraliserende antistoffer, men kun i uge 4 (Dodick et al., 2018). Også det kliniske fase III STRIVE-forsøg (ClinicalTrials.gov NCT02456740) vurderede effektiviteten af erenumab til forebyggelse af episodisk migræne. Erenumab blev administreret med 70 eller 140 mg månedligt i 6 måneder (Goadsby et al., 2017b). Det gennemsnitlige antal MMD’er ved baseline var 8,3, og doserne på 70 mg og 140 mg reducerede det med henholdsvis 3,2 og 3,7 dage sammenlignet med 1,8 dage med placebo (med p < 0,001 for hver dosis vs. placebo) (Goadsby et al., 2017b) (Goadsby et al., 2017b). Også i løbet af de sidste 3 måneders behandling opfyldte hver dosis erenumab de sekundære endepunkter på mindst 50 % reduktion fra baseline i det gennemsnitlige antal migrænedage pr. måned og reduktion fra baseline i både Migraine Physical Function Impact Diary (MPFID) hverdags-aktiviteter (MPFID-EA) og fysisk-værge (MPFID-PI) (Goadsby et al., 2017b) (Goadsby et al., 2017b). Hos de patienter med anti-erenumab-antistoffer var der kun én i den gruppe, der blev behandlet med 70 mg, der blev testet positiv for neutraliserende antistoffer, og mAb’et blev generelt godt tolereret med hensyn til kreatininniveauer, levertoksicitet, total antal neutrofiler og elektrokardiografisk funktion (Goadsby et al., 2017b). Ifølge forfatterne er en af begrænsningerne ved dette forsøg, at patienter, der ikke havde vist terapeutisk respons på mere end to klasser af migræneforebyggende lægemidler, blev udelukket (Goadsby et al., 2017b). Desuden er der kliniske forsøg, der undersøger effektiviteten af fremanezumab (NCT02945046 og NCT02964338) og galcanezumab (NCT 02397473 og NCT02438826) til forebyggelse af klyngehovedpine (se Israel et al., 2018), dvs. primær hovedpine karakteriseret ved alvorlig ensidig smerte i det periorbitale område ledsaget af tårer, konjunktival rødme og rhinorrhea (Vollesen et al., 2018). Det blev faktisk påvist, at kontinuerlig intravenøs infusion gennem infusionspumpe af 1,5 μg/min af CGRP i 20 min (i 2 dage adskilt af mindst 7 dage) til patienter med episodisk (aktiv eller remissionsfase) eller kronisk klyngehovedpine fremkaldte klyngelignende anfald hos patienter i aktiv fase eller med kronisk klyngehovedpine, men ikke i remissionsfasen (ClinicalTrials.gov NCT02466334) (Vollesen et al., 2018). De vigtigste PK-fordele ved mAbs er repræsenteret af lang eliminationshalveringstid, hvilket begrænser behovet for daglig dosering og clearance ved proteolyse. På grund af gepants virkninger på leveren og på grund af CGRP’s vasodilaterende egenskaber består de mest frygtede risici ved hæmning af CGRP-signalering i den hypotese om hepatotoksicitet og kardiovaskulær teoretisk risiko (Yuan et al., 2017). European Headache Federation (EHF) har udarbejdet retningslinjer for brugen af anti-CGRP mAbs, der anvender GRADE-metoden (Grading of Recommendation, Assessment, Development and Evaluation) og, når det ikke er muligt, stoler på udtalelsen fra et ekspertpanel (Sacco et al., 2019).
Pharmakokinetik (PK)/Pharmakodynamik (PD)-forholdet mellem mAbs mod migræne
Udviklingen af mAbs har repræsenteret en helt ny tilgang til at hæmme CGRP-signalvejen. Den vigtigste PD-forbedring, der opnås ved at anvende mAbs i stedet for små molekyler, er, at det er lettere at målrette det brede CGRP-receptor-ligandbindingssted (Taylor, 2018). De vigtigste PK-fordele ved mAbs er repræsenteret ved lang eliminationshalveringstid uden behov for daglig dosering og clearance ved proteolyse, og de mest frygtede risici ved inhibering af CGRP-signalering består i den hypotese om hepatotoksicitet på grund af gepants virkninger på leveren og kardiovaskulær teoretisk risiko på grund af de vasodilaterende egenskaber ved CGRP. Men efter disse mAbs’ rejse fra produktion til mål er den første hindring, som disse molekyler møder, deres administration på grund af deres begrænsede orale biotilgængelighed. Derfor er der behov for en parenteral administrationsvej, og for at fremme adhærens til behandlingen skal halveringstiden være lang (Taylor, 2018). Immunoglobuliner (Ig)G1, 2 eller 4 er mulighederne (Wang et al., 2008; Taylor, 2018). Bortset fra IgG’ernes oprindelse kan eventuel krydsreaktivitet og individuelle modifikationer af katabolismen påvirke halveringstiden (Bonilla, 2008; Taylor, 2018). Den teknologi, der anvendes til fremstilling af mAbs, er baseret på brugen af hybridomer, der består af celler i kontinuerlig deling, som producerer bestemte kloner af en enkelt type antistof uden eller med lav variabilitet (Taylor, 2018). På grundlag af oprindelsen af de aminosyrer, der udgør mAb’et, er det muligt at skelne mellem chimære (immunisering af gnavere; opretholdelse af gnaverfragmentets antigenbindende region Fab, men indførelse af det humane Fragment krystalliserbare region Fc), humaniserede (zumabs, med musekomplementaritetsbestemmende regioner, CDR’er, podet på humane Fab-regioner) og humane (indførelse af hele sekvensen af det humane antistofgen i musen, som bliver humaniseret, som f.eks. XenoMouse) mAbs (se Taylor, 2018). CDR’erne har indflydelse på tilpasningen til målet. Blandt de 4 mAbs mod migræne er kun erenumab humant, mens de podede CDR’er er fra mus for fremanezumab, kanin for eptinezumab og sandsynligvis mus for galcanezumab (se Taylor, 2018). Især er det eneste anti-CGRP-receptor-mabstof erenumab, som er et humant IgG2λ, og de tre andre mAbs, der er rettet mod steder af CGRP, er: eptinezumab, et genetisk manipuleret humaniseret IgG1k; fremanezumab, et humaniseret IgG2k; galcanezumab, et humaniseret IgG4 (Edvinsson et al., 2018). Erenumab (Tmax 3-14 dage) kræver månedlig subkutan administration, ligesom fremanezumab (Tmax 3-20 dage) og galcanezumab (Tmax 7-14 dage) (Taylor, 2018). Derimod administreres eptinezumab (Tmax 4,8 timer) intravenøst en gang hver 3. måned; det associeres hurtigere og dissocieres langsommere end fremanezumab og galcanezumab. Da mAbs er proteiner af stor størrelse, kan de ikke let krydse BBB. Nogle CGRP-receptorer befinder sig uden for BBB, hvilket gør det muligt for anti-CGRP mAbs at virke (Edvinsson, 2018). Før bindingen kommer antistoffet ind i vaskulære endotelceller via pinocytose. Store tilsyneladende fordelingsvolumener kan afhænge af vævet og den tilhørende bindingskapacitet for mAb’et (Lobo et al., 2004; Taylor, 2018). Erenumab er den mest nye tilgang, da det er den eneste, der er rettet mod et fusionsprotein af de ekstracellulære domæner af den humane G-protein-koblede receptor calcitoninreceptorlignende receptor CALCRL (der kræves i receptorerne for CGRP og adrenomedullin) og RAMP1, herunder CGRP-bindingslommen (Edvinsson et al., 2018). Det er blevet påvist, at det kompetitivt hæmmer bindingen af -CGRP til den humane CGRP-receptor i humane neuroblastomceller (SK-N-MC) med en Ki på 0,02 ± 0,01 nM (Shi et al., 2016). Erenumab udøvede potent og fuld antagonisme af CGRP-stimuleret cAMP-akkumulering med en IC50 på 2,3 ± 0,9 nM i funktionelle assays udført i SK-N-MC (Shi et al., 2016). Desuden resulterede det 5000-fold mere selektivt for CGRP-receptor, der ikke viste nogen agonist/antagonistvirkning på andre humane calcitonin-familie-receptorer, herunder adrenomedullin-, calcitonin- og amylinreceptorer op til den højeste testede koncentration på 10 μM (Shi et al., 2016). Fremanezumab kan udøve sin virkning på forskellige kar; faktisk forårsager det koncentrationsafhængig hæmning af CGRP-induceret vasodilatation i præ-kontraherede humane cerebrale, meningeale og perifere abdominale arterier (Ohlsson et al., 2018). Desuden kan CGRP også virke på neuroner og gliaceller og på det glymphatiske (lymfe-lignende), idet sidstnævnte er impliceret i udtrykket af aura (se Messlinger, 2018). Den sandsynlige fravær af metabolisme af leverenzymer kunne undgå lægemiddel-lægemiddelinteraktioner. Eliminering sker gennem renal proteolyse af aminosyrer. Selv om kliniske forsøg rapporterer, at disse antistoffer generelt tolereres godt, bortset fra den fremhævede smerte på injektionsstedet, er der bekymring med hensyn til deres immunogenicitet gennem produktion af ADA (Taylor, 2018). Under et dobbeltblindet, randomiseret, placebokontrolleret klinisk forsøg (ClinicalTrials.gov NCT 01337596), der evaluerede behandlingen med forskellige regimer af enkelt- og flerdoser af galcanezumab, præsenterede 11 af de behandlede patienter (26 %) lave titre (1:10 – 1:80) af behandlingsmergement-ADA (hos 3 patienter steg de allerede eksisterende antistoffer i titer), uden dosisrespons og påviste virkninger på PK og PD (Monteith et al., 2017). Undersøgelsen af immunogenicitet er afgørende, fordi tilstedeværelsen af ADA kan fremskynde fjernelse af lægemidler eller, værre endnu, fremme skader på slutorganer (Taylor, 2018). De vigtigste egenskaber ved anti-migræne mAbs er opsummeret i tabel 1.

Tabel 1. Hovedkarakteristika for fremanezumab, eptinezumab, galcanezumab og erenumab.
Konklusion
Migræne er en invaliderende og invaliderende neurovaskulær smertefuld tilstand, der repræsenterer mere end 90 % af tilfældene af tilbagevendende hovedpine, og hvortil tendensen kan være arvelig (MacGregor, 2017). Divalproex natrium, natriumvalproat, topiramat, metoprolol, propranolol og timolol har vist stærk, niveau A, evidens for forebyggelse af migræne (American Academy of Neurology og American Headache Society, 2015). Alle de klassiske orale forebyggende behandlinger, herunder tricykliske antidepressiva, betablokkere, 5-HT2-antagonister ergots og antiepileptika, blev imidlertid ikke udviklet til migræne og giver kun 50 % reduktion i antallet af månedlige dage med migrænesmerter for 45 % af migrænepatienterne (D’Amico og Tepper, 2008), også på grund af lav adhærens på grund af ringe tolerabilitet. Vedligeholdelse og ophør af medicinering blev undersøgt i en retrospektiv amerikansk analyse af erstatningskrav (Hepp et al., 2017), og resultaterne tyder på lav vedholdenhed i forhold til det oprindeligt anvendte lægemiddel og en høj grad af ophør efter 6 måneder uafhængigt af lægemiddelklasse. På grund af CGRP’s grundlæggende rolle i opretholdelsen af neuroinflammation og central sensibilisering i vejen fra trigeminusganglien og hjernestammen til højere regioner, der er involveret i migrænefysiopatologien, er der blevet udviklet nye mAbs mod CGRP og dets receptor. De første små molekyler CGRP-antagonister viste sig at inducere levertoksicitet, men mAbs producerede hverken toksiske metabolitter eller kardiovaskulære bivirkninger på grund af hæmning af vasodilatation (se Deen et al., 2017). Centrale bivirkninger blev heller ikke fremhævet. De potentielle langtidsvirkninger af blokering af CGRP skal stadig undersøges, men en grundlæggende fordel ved disse antistoffer stammer fra deres lange halveringstid, hvilket muliggør månedlige eller mindre hyppige injektioner, hvilket kan forbedre tilslutningen til behandlingen og dens efterfølgende effektivitet bemærkelsesværdigt (Deen et al., 2017). Anti-CGRP mAbs kunne således udgøre effektive værktøjer i det terapeutiske arsenal mod uresponsiv migræne; det er dog obligatorisk at foretage en grundig overvågning af effektivitet og sikkerhed (dvs. produktion af toksiske metabolitter, immunogenicitet med ADA, neutraliserende antistoffer og vævskrydsreaktivitet og bivirkninger) (Taylor, 2018). Faktisk viser beviser fra ældre bioteknologiske produkter, at behandlinger med anti-tumor nekrosefaktor α (TNFα) mAbs kan være udsat for sekundær fiasko (i modsætning til primære non-responders) af det oprindelige terapeutiske respons, fordi disse lægemidler inducerer produktionen af antistoffer, der kan nedbryde mAb’et, men også kan neutralisere dets virkning, før det binder sig til målet (se Prado et al., 2017). Immunogeniciteten kan påvirkes af glykosylering, typen af mAb, antallet af epitoper og urenheder i formuleringen (se Prado et al., 2017). Desuden er flere tilsyneladende uforklarlige alvorlige bivirkninger forbundet med immunogenicitet af anti-TNFα. Lokale og systemiske overfølsomhedsreaktioner, immundefekt med øget modtagelighed for infektioner og dannelse af immunkomplekser, som endog kan føre til døden, er blevet fremhævet (se Prado et al., 2017). Derfor kan brugen af terapeutisk diagnostik (theranostik) forbedre kendskabet til og den korrekte håndtering af disse farmakologiske anordninger (Bendtzen, 2013; Prado et al., 2017).
Author Contributions
MTC, LAM, PT og GB udtænkte undersøgelsen. DS indsamlede forsøgsresultaterne, analyserede litteraturen og skrev manuskriptet. AA, LR og MN deltog i litteraturundersøgelsen. Alle forfattere læste og godkendte det endelige manuskript.
Interessekonflikter
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller økonomiske relationer, der kunne opfattes som en potentiel interessekonflikt.
American Academy of Neurology og American Headache Society (2015). Bilag a: Resumé af evidensbaseret retningslinje for klinikere, opdatering: farmakologisk behandling til forebyggelse af episodisk migræne hos voksne. Continuum 21, 1165-1166. doi: 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | CrossRef Full Text | Google Scholar
Bendtzen, K. (2013). Personaliseret medicin: Theranostik (terapeutisk diagnostik) afgørende for rationel anvendelse af tumornekrosefaktor-alfa-antagonister. Discov. Med. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). Farmakokinetik af immunglobulin, der administreres via intravenøs eller subkutan vej. Immunol. Allergy Clin. North Am. 28, 803-819. doi: 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Kollegaer, G. B. D. H. (2018). Global, regional og national byrde af migræne og spændingshovedpine, 1990-2016: en systematisk analyse til den globale sygdomsbyrdeundersøgelse 2016. Lancet Neurol. 17, 954-976. doi: 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., og Tepper, S. J. (2008). Profylakse af migræne: generelle principper og patientaccept. Neuropsychiatr. Dis. Treat. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Papetti, L., Rubio-Beltran, E., et al. (2017). Blokering af CGRP hos migrænepatienter – en gennemgang af fordele og ulemper. J. Headache Pain 18:96. doi: 10.1186/s10194-017-0807-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V., et al. (2018). ARISE: et fase 3 randomiseret forsøg med erenumab til behandling af episodisk migræne. Cephalalgia 38, 1026-1037. doi: 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D., og Lance, J. W. (1983). Ekstrakranielle vaskulære ændringer og kilden til smerte ved migrænehovedpine. Ann. Neurol. 13, 32-37. doi: 10.1002/ana.410130108
PubMed Abstract | CrossRef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J. Y., Ossipov, M. H., Dodick, D. W., og Porreca, F. (2014). Målretning af TRP-kanaler for nye migræneterapeutika. ACS Chem. Neurosci. 5, 1085-1096. doi: 10.1021/cn500083e
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2015). CGRP-receptorantagonister og antistoffer mod CGRP og dets receptor i migrænebehandling. Br. J. Clin. Pharmacol. 80, 193-199. doi: 10.1111/bcp.12618
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2018). CGRP-vejen i migræne som et levedygtigt mål for terapier. Headache 58(Suppl. 1), 33-47. doi: 10.1111/head.13305
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L., Haanes, K. A., Warfvinge, K., og Krause, D. N. (2018). CGRP som mål for nye migræneterapier – vellykket oversættelse fra bænk til klinik. Nat. Rev. Neurol. 14, 338-350. doi: 10.1038/s41582-018-0003-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Eftekhari, S., Warfvinge, K., Blixt, F. W., og Edvinsson, L. (2013). Differentiering af nervefibre, der lagrer CGRP og CGRP-receptorer i det perifere trigeminovaskulære system. J. Pain 14, 1289-1303. doi: 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, M. S., Cheng, X., Jeffry, J. A., Disney, K. E., og Premkumar, L. S. (2012). Sumatriptan hæmmer TRPV1-kanaler i trigeminusneuroner. Headache 52, 773-784. doi: 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B., og Goadsby, P. J. (2001). Orale triptaner (serotonin 5-HT(1B/1D)-agonister) i akut migrænebehandling: en metaanalyse af 53 forsøg. Lancet 358, 1668-1675. doi: 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K., and Lainez, M. J. A. (2018). De forebyggende virkninger af galcanezumab hos voksne patienter med episodisk eller kronisk migræne er vedvarende: data fra de fase 3, randomiserede, dobbeltblindede, placebokontrollerede EVOLVE-1, EVOLVE-2 og REGAIN-undersøgelser. J. Headache Pain 19:121. doi: 10.1186/s10194-018-0951-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F., og Martelletti, P. (2017). Calcitonin-genrelateret peptidreceptor som et nyt mål for behandling af personer med episodisk migræne: nuværende dokumentation og sikkerhedsprofil for erenumab. J. Pain Res. 10, 2751-2760. doi: 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., og Martelletti, P. (2015). Nye lægemidler til behandling af migræne. Expert Opin. Emerg. Drugs 20, 137-147. doi: 10.1517/14728214.2015.999040
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Edvinsson, L., og Ekman, R. (1990). Vasoaktiv peptidfrigivelse i den ekstracerebrale cirkulation hos mennesker under migrænehovedpine. Ann. Neurol. 28, 183-187. doi: 10.1002/ana.410280213
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Holland, P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C., og Akerman, S. (2017a). Patofysiologi af migræne: en forstyrrelse af sensorisk behandling. Physiol. Rev. 97, 553-622. doi: 10.1152/physrev.00034.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J. H., Zhang, F., et al. (2017b). Et kontrolleret forsøg med erenumab til episodisk migræne. N. Engl. J. Med. 377, 2123-2132. doi: 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P., et al. (2017). Persistens og skiftemønstre af orale migræneprofylaktiske lægemidler blandt patienter med kronisk migræne: en retrospektiv skadesanalyse. Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J., et al. (2012). Randomiseret, kontrolleret undersøgelse af telcagepant hos patienter med migræne og koronararteriesygdom. Headache 52, 224-235. doi: 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L., og Reuter, U. (2018). CGRP monoklonale antistoffer til forebyggende behandling af migræne. Curr. Pain Headache Rep. 22:38. doi: 10.1007/s11916-018-0686-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M., og Martelletti, P. (2018). Nye lægemidler til behandling af migræne: en opdatering. Expert Opin. Emerg. Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B., og Olesen, J. (2002). CGRP kan spille en årsagsskabende rolle ved migræne. Cephalalgia 22, 54-61. doi: 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E. D., Hansen, R. J., og Balthasar, J. P. (2004). Farmakokinetik og farmakodynamik for antistoffer. J. Pharm. Sci. 93, 2645-2668. doi: 10.1002/jps.20178
PubMed Abstract | CrossRef Full Text | Google Scholar
MacGregor, E. A. (2017). Migræne. Ann. Intern. Med. 166, ITC49-ITC64. doi: 10.7326/AITC20170404040
PubMed Abstract | CrossRef Full Text | Google Scholar
Martelletti, P. (2017). Anvendelse af CGRP(r)-monoklonale antistoffer i migrænespektrum: behov og prioriteter. BioDrugs 31, 483-485. doi: 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). Den store CGRP-flood – kilder, dræn og signaleringssteder i det trigeminovaskulære system. J. Headache Pain 19:22. doi: 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., Vandermeulen, C., Van Hecken, A., Raddad, E., Scherer, J. C., et al. (2017). Sikkerhed, tolerabilitet, farmakokinetik og farmakodynamik af det CGRP-bindende monoklonale antistof LY2951742 (Galcanezumab) hos raske frivillige. Front. Pharmacol. 8:740. doi: 10.3389/fphar.2017.00740
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J., og Edvinsson, L. (2018). Fremanezumab blokerer CGRP-induceret dilatation i humane cerebrale, midterste meningeal- og abdominalarterier. J. Headache Pain 19:66. doi: 10.1186/s10194-018-0905-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Prado, M. S., Bendtzen, K., og Andrade, L. E. C. (2017). Biologiske anti-TNF-lægemidler: immunogenicitet, der ligger til grund for behandlingssvigt og bivirkninger. Expert Opin. Drug Metab. Toxicol. 13, 985-995. doi: 10.1080/17425255.2017.1360280
PubMed Abstract | CrossRef Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X., og Brain, S. D. (2014). Calcitonin-genrelateret peptid: fysiologi og patofysiologi. Physiol. Rev. 94, 1099-1142. doi: 10.1152/physrev.00034.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U., Terwindt, G., Mitsikostas, D. D., et al. (2019). European headache federation guideline on the use of monoclonal antibodies acting on the calcitonin gene related peptide or its receptor for migraine prevention. J. Headache Pain 20:6. doi: 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., Dodick, D., Silberstein, S., et al. (2018). Primære resultater af PROMISE-1-forsøget (forebyggelse af migræne via intravenøs eptinezumab sikkerhed og effekt-1): et fase 3, randomiseret, dobbeltblindet, placebokontrolleret studie til evaluering af effekten og sikkerheden af eptinezumab til forebyggelse af hyppig episodisk migræne (S20.001). Neurology 90(15 Suppl.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al. (2016). Farmakologisk karakterisering af AMG 334, et potent og selektivt humant monoklonalt antistof mod calcitonin-genrelateret peptidreceptor. J. Pharmacol. Exp. Ther. 356, 223-231. doi: 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K., og Yang, J. Y. (2018). Effektivitet og sikkerhed af galcanezumab til forebyggelse af episodisk migræne: Resultater af det randomiserede, kontrollerede kliniske fase 3-studie EVOLVE-2. Cephalalgia 38, 1442-1454. doi: 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J., og Conley, R. R. (2018). Evaluering af galcanezumab til forebyggelse af episodisk migræne: det randomiserede kliniske forsøg EVOLVE-1. JAMA Neurol. 75, 1080-1088. doi: 10.1001/jamaneurol.2018.1212
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R., og Katsarava, Z. (2018). Migræne er den første årsag til invaliditet hos personer under 50 år: Vil sundhedspolitikerne nu tage notits af det? J. Headache Pain 19:17. doi: 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R. (2018). CGRP, amylin, immunologi og hovedpine medicin. Headache 59, 131-150. doi: 10.1111/head.13432
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al. (2017). Migræne biomarkører i cerebrospinalvæske: en systematisk gennemgang og meta-analyse. Cephalalgia 37, 49-63. doi: 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A. L. H., Snoer, A., Beske, R. P., Guo, S., Hoffmann, J., Jensen, R. H., et al. (2018). Effekt af infusion af calcitonin-genrelateret peptid på klyngehovedpineanfald: et randomiseret klinisk forsøg. JAMA Neurol. 75, 1187-1197. doi: 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, C. S., Conner, A. C., A. C., Poyner, D. R., og Hay, D. L. (2010). Regulering af signaltransduktion af calcitonin-genrelaterede peptidreceptorer. Trends Pharmacol. Sci. 31, 476-483. doi: 10.1016/j.tips.2010.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, E. Q., og Balthasar, J. P. (2008). Farmakokinetik og farmakodynamik for monoklonale antistoffer. Clin. Pharmacol. Ther. 84, 548-558. doi: 10.1038/clpt.2008.170
PubMed Abstract | CrossRef Full Text | Google Scholar
Xanthos, D. N., og Sandkuhler, J. (2014). Neurogen neuroinflammation: inflammatoriske CNS-reaktioner som reaktion på neuronal aktivitet. Nat. Rev. Neurosci. 15, 43-53. doi: 10.1038/nrn3617
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, H., Lauritsen, C. G., Kaiser, E. A., og Silberstein, S. D. (2017). CGRP monoklonale antistoffer mod migræne: Rationalitet og fremskridt. BioDrugs 31, 487-501. doi: 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar