Fysiske egenskaber ved ioniske vs. kovalente forbindelser
I almindelighed har ioniske og kovalente forbindelser forskellige fysiske egenskaber. Ioniske forbindelser danner hårde krystallinske faste stoffer, der smelter ved høje temperaturer og er modstandsdygtige over for fordampning. Disse egenskaber stammer fra den karakteristiske indre struktur af et ionisk fast stof, som er illustreret skematisk i del (a) i figur 2.7.4, der viser den tredimensionelle række af vekslende positive og negative ioner, der holdes sammen af stærke elektrostatiske tiltrækninger. I modsætning hertil, som vist i del (b) i figur 9.5.1, består de fleste kovalente forbindelser af diskrete molekyler, der holdes sammen af forholdsvis svage intermolekylære kræfter (kræfterne mellem molekylerne), selv om atomerne i hvert molekyle holdes sammen af stærke intramolekylære kovalente bindinger (kræfterne inden for molekylet). Kovalente stoffer kan være gasser, væsker eller faste stoffer ved stuetemperatur og tryk, afhængigt af styrken af de intermolekylære vekselvirkninger. Kovalente molekylære faste stoffer har tendens til at danne bløde krystaller, der smelter ved lave temperaturer og let fordamper.
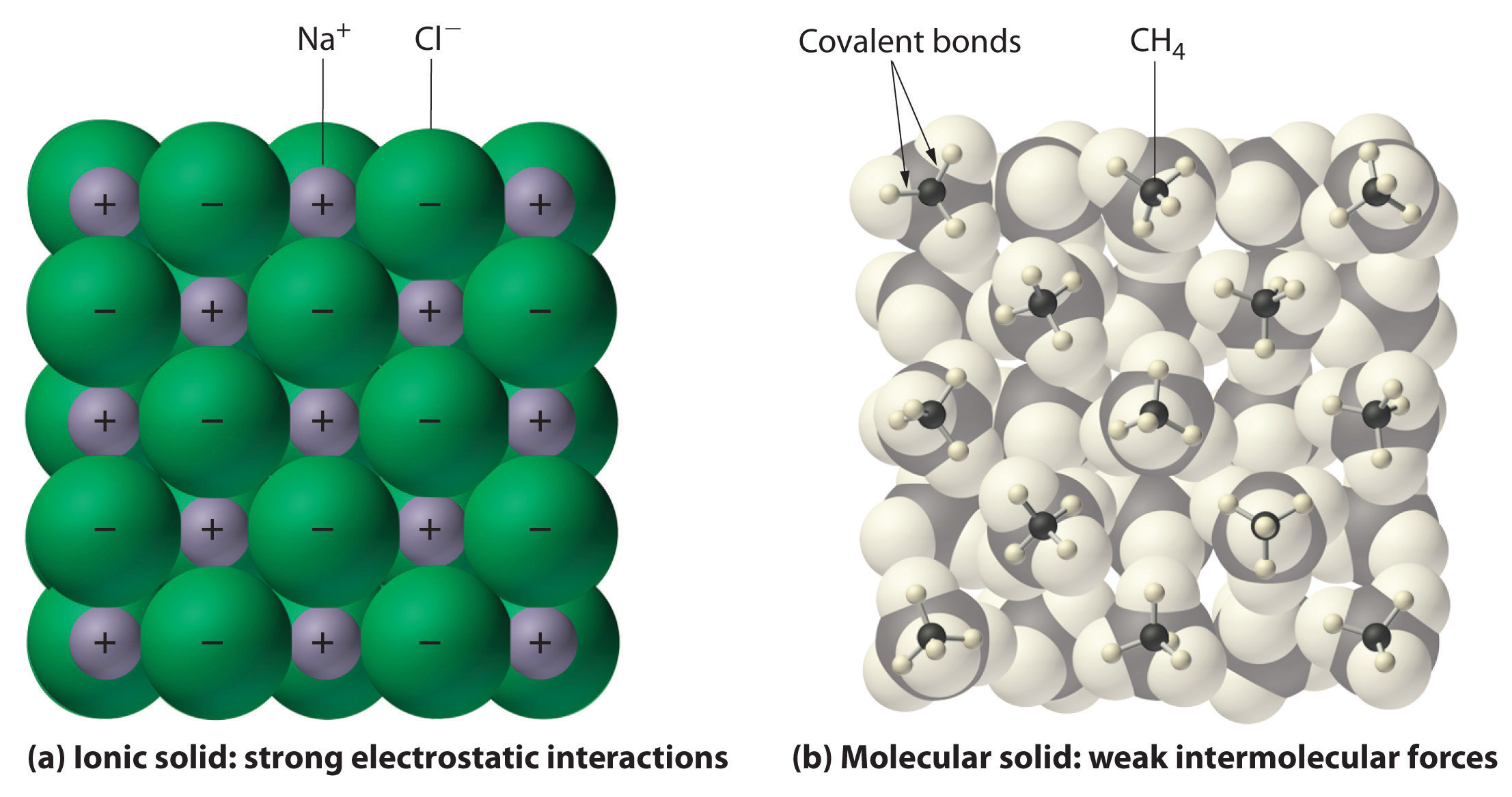
Figur 9.5.1: Interaktioner i ioniske og kovalente faste stoffer. (a) De positivt og negativt ladede ioner i et ionisk fast stof som f.eks. natriumchlorid (NaCl) holdes sammen af stærke elektrostatiske vekselvirkninger. (b) I denne fremstilling af pakningen af metan (\(CH_4\))-molekyler i fast metan, et prototypisk molekylært fast stof, holdes metanmolekylerne kun sammen i det faste stof af relativt svage intermolekylære kræfter, selv om atomerne i hvert metanmolekyle holdes sammen af stærke kovalente bindinger.
Kulbrinter
Molekylære faste stoffer består af atomer eller molekyler, der holdes sammen af dipol-dipol-vekselvirkninger, London-dispersionskræfter eller hydrogenbindinger eller en kombination af disse. Arrangementet af molekylerne i fast benzen er som følger:

Figur 9.5.2: Strukturen af fast benzen. I fast benzen er molekylerne ikke anbragt med deres planer parallelt med hinanden, men i 90° vinkler.
Da de intermolekylære vekselvirkninger i et molekylært fast stof er relativt svage sammenlignet med ioniske og kovalente bindinger, har molekylære faste stoffer en tendens til at være bløde, lavt smeltende og let fordampelige (\(ΔH_{fus}\) og \(ΔH_{vap}\) er lave). For lignende stoffer stiger styrken af London-dispersionskræfterne jævnt med stigende molekylmasse. F.eks. er smeltepunkterne for benzen (C6H6), naftalen (C10H8) og antracen (C14H10) med en, to og tre kondenserede aromatiske ringe henholdsvis 5,5 °C, 80,2 °C og 215 °C. Fusionsenthalpierne stiger også jævnt inden for serien: benzen (9,95 kJ/mol) < naftalen (19,1 kJ/mol) < antracen (28,8 kJ/mol). Hvis molekylerne har former, der ikke kan pakkes effektivt sammen i krystallen, har smeltepunkterne og fusionsenthalpierne imidlertid tendens til at være uventet lave, fordi molekylerne ikke er i stand til at arrangere sig således, at de optimerer de intermolekylære interaktioner. Således har toluen (C6H5CH3) og m-xylen smeltepunkter på henholdsvis -95°C og -48°C, hvilket er betydeligt lavere end smeltepunktet for den lettere, men mere symmetriske analog, benzen.
Selvhelbredende gummi er et eksempel på et molekylært fast stof med potentiale for betydelige kommercielle anvendelser. Materialet kan strække sig, men når det knækkes i stykker, kan det binde sig sammen igen gennem genetablering af sit hydrogenbindingsnetværk uden at vise tegn på svaghed. Blandt andre anvendelser undersøges det med henblik på anvendelse i klæbemidler og cykeldæk, der vil helbrede sig selv.

Figur 9.5.3: Toluen og m-xylen. Methylgrupperne, der er knyttet til phenylringen i toluen og m-xylen, forhindrer ringene i at pakke sig sammen lige så godt som i fast benzen.