24-6C Reaktioner af nitroforbindelser
Nitroforbindelser er ret ustabile i termodynamisk forstand; f.eks. er nedbrydningsvarmen for nitromethan ifølge følgende stoiometri \(67.4 \: \text{kcal mol}^{-1}\).
Den betydelige energi og den hurtige hastighed af reaktioner som denne udnyttes til kommerciel brug af nitroforbindelser som sprængstoffer. Med nogle nitroforbindelser, som f.eks. TNT, er der yderligere den fordel, at de er meget lidt stødfølsomme.
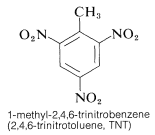
TNT detonerer ikke let ved en simpel stødpåvirkning og brænder endda uden at eksplodere. Når detonationen først er begyndt, forplanter nedbrydningen sig imidlertid hurtigt. Egenskaberne rimelig håndteringsstabilitet og højt termodynamisk potentiale gør nitroforbindelser særligt anvendelige. Andre polynitroforbindelser, der er anvendelige som sprængstoffer, omfatter PETN (afsnit 17-3C), cyclonit (afsnit 16-4C), pikrinsyre og tetryl:
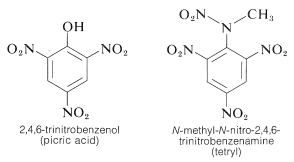
En vigtig egenskab ved aromatiske polynitroforbindelser er deres evne til at danne “ladningsoverførsels”-komplekser med aromatiske kulbrinter, især dem, der er substitueret med alkylgrupper. Komplekser af 2,4,6-trinitrobenzenol (pikrinsyre) og aromatiske carbonhydrider er ofte krystallinske faste stoffer, som er nyttige til adskillelse, rensning og identifikation af aromatiske carbonhydrider. Disse stoffer kaldes “kulbrintepikrater”, men navnet er misvisende, da de faktisk ikke er salte. Desuden dannes der lignende komplekser mellem aromatiske kulbrinter og trinitrobenzen, hvilket viser, at det er nitrogrupperne og ikke hydroxylgruppen, der er afgørende for kompleksdannelsen. Bindingen i disse komplekser ligner den i \(\pi\)-komplekser af halogener med alkener og benzen (afsnit 22-4D og 10-3C) og skyldes tiltrækningskræfter mellem elektronrige og elektronfattige stoffer. Det beskrivende navn – ladningsoverførselskompleks – antyder, at komplekset har VB-strukturer, der indebærer overførsel af en elektron fra donor- (elektronrigt) molekyle til acceptormolekylet (elektronfattigt). Navnet \(\pi\)-kompleks anvendes også, fordi mindst én komponent i komplekset normalt har et \(\pi\)-elektronsystem. Ladningsoverførsels- eller \(\pi\)-komplekser mellem polynitroforbindelser og aromatiske kulbrinter synes at give sandwich-lignende strukturer med de aromatiske ringe i parallelle planer, selv om de ikke nødvendigvis er centreret nøjagtigt over hinanden:
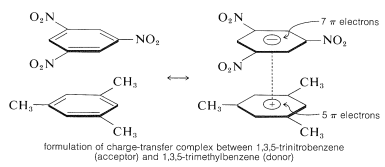
Ladningsoverførselskomplekser er næsten altid mere stærkt farvet end deres individuelle komponenter. Et spektakulært eksempel er benzen og tetracyanoethen, som hver for sig er farveløse, men som giver et lysende orangefarvet kompleks, når de blandes. Et skift mod længere bølgelængder i absorptionen i forhold til deres komponenter kan forventes for ladningsoverførselskomplekser på grund af den øgede mulighed for stabilisering af den exciterede tilstand gennem elektrondelokalisering, der involverer begge komponenter.
Reduktion af nitroforbindelser sker let med en række forskellige reduktionsmidler, og sådanne reduktioner giver mulighed for en særlig nyttig syntese af aromatiske aminer (afsnit 23-12B):
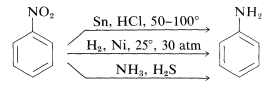
Reduktionen af en nitroforbindelse til en amin kræver seks ækvivalenter reduktionsmiddel:
Man ville ikke forvente, at en sådan reduktion sker i et enkelt trin. Reduktionen er nemlig trinvis og foregår gennem en række mellemprodukter, som med stærke reduktionsmidler i syreopløsning højst har en forbigående eksistens. De mellemprodukter, der dannes successivt fra \(\ce{RNO_2}}\) ved trinvis forøgelse af to ækvivalenter reduktionsmiddel, er nitroforbindelser, \(\ce{R-N=O}}\), og \(\ce{N}}\)-substituerede azanoler (hydroxylaminer), \(\ce{RNHOH}\):
\}{\longrightarrow}} \ce{RN=O} \overset{2 \left}{\longrightarrow} \ce{RNHOH} \underset{-\ce{H_2O}}{\overset{2 \left}{\longrightarrow}} \ce{RNH_2}\]
Sådan kan \(\ce{N}\)-aryl-substituerede azanoler fremstilles direkte fra de tilsvarende nitroforbindelser med zink- og ammoniumchloridopløsning. Zink og saltsyre giver imidlertid aminen:
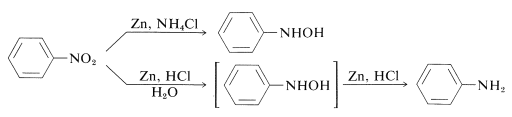
Den forskel, der er mellem disse reaktioner, ligger i reduktionshastigheden i forbindelse med opløsningens surhedsgrad. Ammoniumchlorid er en meget svagere syre end \(\ce{HCl}\); pH-værdien af ammoniumchloridopløsninger er omkring 6.
Oxidation af \(\ce{N}}\)-arylazanoler under kontrollerede forhold giver nitrosforbindelser. Denne reaktion er ikke ulig oxidationen af alkoholer til ketoner (afsnit 15-6B):
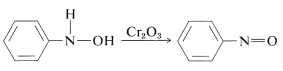
Reduktion af arylnitroforbindelser med mindre kraftige reduktionsmidler, især i alkaliske medier, giver, hvad der kan synes at være et mystisk konglomerat af bimolekylære reduktionsprodukter. For eksempel med nitrobenzen,
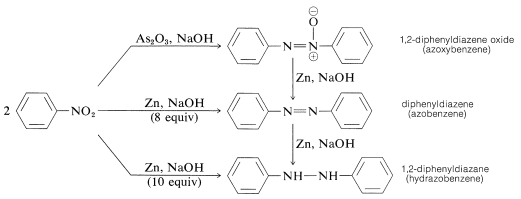
Alle disse stoffer kan reduceres til benzenamin med tin og saltsyre. Som følge heraf kan de alle være, men er ikke nødvendigvis, et mellemprodukt i reduktionen af nitroforbindelser til aminer. Dannelse af de bimolekylære reduktionsprodukter er resultatet af baseinducerede reaktioner mellem nitroforbindelser og azanoler eller aminer og muligvis yderligere reduktion af de oprindeligt producerede stoffer.
Skrevne polynitrobenzenderivater har vigtige herbicidale anvendelser. Som eksempler kan nævnes \(\ce{N}^3\), \(\ce{N}^3\)-diethyl-6-trifluormethyl-2,4-dinitro-1,3-benzendiamin og \(\ce{N}\),\(\(\ce{N}\),\(\(\ce{N}\)-dipropyl-4-trifluormethyl-2,6-dinitrobenzenamin:
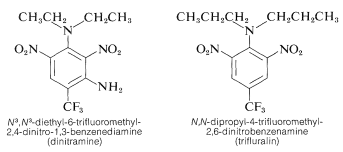
Disse stoffer, når de blandes med jord, dræber ukrudtsfrøplanter, men ikke afgrødeplanter som bomuld, sojabønner og jordnødder. Aktiviteten er høj; normalt kræves der kun ca. \(0,08 \(0,08 \: \text{g m}^{-2}\) for god ukrudtsbekæmpelse.
De vigtigste reaktioner af nitroalkaner er dem, der involverer de primære og sekundære forbindelsers \(\alpha\) hydrogenser. For eksempel er nitromethan tilstrækkelig sur til at opløses i vandige hydroxidopløsninger. Den således dannede anion har en elektronisk struktur svarende til nitratanionen:
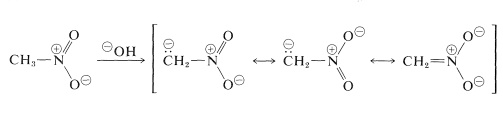
En interessant egenskab ved denne ion er, at der ved forsuring af opløsninger af den dannes en ustabil, ret stærkt sur isomer af nitromethan (kaldet aci-formen), som langsomt går tilbage til den mere stabile nitroform:
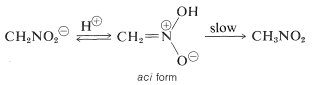
Samme ændringer finder sted ved forsuring af enolsaltet af en carbonylforbindelse, idet den væsentligste forskel er den meget længere levetid for aci-nitroforbindelsen sammenlignet med levetiden for en enol af en simpel keton (se afsnit 17-1B).
Primære og sekundære nitroforbindelser gennemgår aldoladditioner og Michaeladditioner med egnede carbonylforbindelser og basiske katalysatorer:
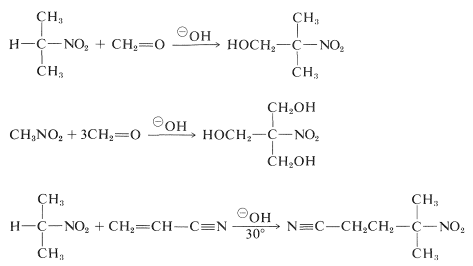
Desværre er alkyleringsreaktioner svarende til den base-katalyserede alkylering af carbonylforbindelser generelt ikke anvendelige til syntese af højere nitroforbindelser, fordi \(\ce{C}\)-alkylering af de konjugerede baser af primære nitroforbindelser er langsommere end \(\ce{O}\)-alkylering.