Complicações mecânicas do infarto agudo do miocárdio (IAM) são: defeito do septo ventricular (CIV), ruptura ou disfunção do músculo papilar, ruptura da parede livre do coração, aneurisma ventricular, obstrução dinâmica da via de saída do ventrículo esquerdo (VE) e falência do ventrículo direito (VD). Todas essas condições podem potencialmente levar à falha do VE com choque cardiogênico.
Um entendimento profundo das complicações mecânicas do IAM e seus fatores de risco pode ajudar os clínicos a fazer um diagnóstico precoce. Para resultados favoráveis do paciente, é necessário um diagnóstico imediato com terapia médica apropriada e intervenção cirúrgica oportuna. Fatores importantes para a mortalidade intra-hospitalar por complicações mecânicas do IAM incluem idade avançada, choque cardiogênico e insuficiência cardiorrespiratória.
Ruptura da parede livre ventricular
VFWR é a complicação mais grave do IAM. O VFWR está geralmente associado a grandes infartos transmurais e expansão de infarto antecedente. É a causa mais comum de morte, atrás apenas da falha do VE, e responde por 15-30% das mortes associadas ao IAM. Incontroversamente a mais catastrófica das complicações mecânicas, a RVFV leva a hemopericárdio agudo e morte por tamponamento cardíaco.
A incidência geral de RVFV varia de 0,8-6,2%. A incidência desta complicação diminuiu ao longo dos anos com melhor controle da pressão arterial sistólica 24 horas; maior uso de terapia de reperfusão, beta bloqueadores e inibidores da ECA; e menor uso de heparina.
Dados do Registro Nacional de Infarto do Miocárdio (NRMI) mostraram uma elevada incidência de mortalidade hospitalar entre os pacientes que receberam terapia trombolítica (12,1%) do que entre os pacientes que não receberam (6,1%). No ensaio Trombólise no Infarto do Miocárdio Fase II (TIMI II), 16% dos pacientes morreram por ruptura cardíaca nas 18 horas seguintes à terapia. Os pacientes que foram submetidos à angioplastia transluminal coronária percutânea (ACTP) tiveram uma incidência de ruptura da parede livre inferior à dos pacientes que receberam terapia trombolítica.
Os fatores de risco para RVFV incluem idade avançada superior a 70 anos, sexo feminino, ausência de IM prévia, ondas Q no ECG, hipertensão durante a fase inicial de STEMI, uso de corticosteroides ou AINE e terapia fibrinolítica mais de 14 horas após o início da STEMI. Os pacientes com histórico de angina de peito, IAM prévio, doença coronariana multivascular e insuficiência cardíaca crônica são menos propensos que outros a desenvolver RVFV do VE porque desenvolvem colaterais e pré-condicionamento isquêmico.
Apresentação clínica do VFWR
VFWR são dramáticos; apresentam-se agudamente ou ocasionalmente subagudamente como pseudoaneurismas; e na maioria das vezes envolvem a parede anterior ou lateral do VE. A maioria dos VFWRs ocorre na primeira semana após o IAM.
Becker et al. classificaram os 3 tipos de RVFV a seguir:
-
Type I – um rasgo abrupto que é frequentemente associado a enfartes anteriores e que ocorre precocemente (dentro de 24 h)
-
Type II – uma erosão do miocárdio infartado na borda entre o miocárdio infartado e viável
-
Type III – uma formação precoce de aneurisma correlacionada com infartos mais antigos e severamente expandidos
Type III geralmente ocorre mais tarde que as rupturas tipo I ou tipo II. A terapia trombolítica acelera a ocorrência de ruptura cardíaca em VFWRs tipo I e tipo II de Becker. Em infartos severamente expandidos (tipo III), a terapia trombolítica diminui a incidência de ruptura cardíaca.
Um pseudoaneurisma é formado quando o pericárdio e o hematoma adjacentes selam uma ruptura ou perfuração do miocárdio. A parede de um pseudo-aneurisma é mais freqüentemente visualizada como uma bolsa aneurismática que se comunica com a cavidade do VE por meio de um pescoço estreito. Esta parede é composta de pericárdio e trombo e/ou hematoma organizado. Ela é desprovida de elementos miocárdicos, enquanto um verdadeiro aneurisma tem todos os elementos da parede miocárdica original e uma base relativamente larga. O pseudoaneurisma pode variar em tamanho e está em alto risco de ruptura.
As apresentações clínicas do VFWR variam dependendo da acuidade, localização e tamanho da ruptura. Pacientes com RVFV aguda apresentam dor torácica grave, dissociação eletromecânica abrupta ou assistolia, colapso hemodinâmico e possivelmente morte. Em cerca de um terço dos pacientes, o curso é subagudo e apresentam sintomas como síncope, hipotensão, choque, arritmia e dor torácica prolongada e recorrente.
Diagnóstico de VFWR
O diagnóstico precoce de VFWR e a intervenção são críticos para a sobrevida do paciente. Um alto índice de suspeita é necessário quando pacientes com IAM apresentam dor torácica grave, choque ou arritmias, e desenvolvimento abrupto de dissociação eletromecânica. Os sinais de ECG de RVFV iminente têm especificidade limitada, mas incluem taquicardia sinusal, defeito de condução intraventricular e elevação persistente ou recorrente do segmento ST.
A ecocardiografia é a ferramenta diagnóstica de escolha. O principal achado diagnóstico é um derrame pericárdico moderado a grande com sinais clínicos e ecocardiográficos de tamponamento pericárdico iminente. Em pacientes com tamponamento cardíaco e dissociação eletromecânica, o derrame pericárdico de moderada a severa aumenta o risco de mortalidade. Os pacientes sem tamponamento cardíaco inicial, embora com menor taxa de mortalidade, ainda devem ser acompanhados, pois a ruptura tardia ainda pode ocorrer. A ausência de derrame pericárdico na ecocardiografia tem alto valor preditivo negativo. Se a capacidade de obtenção do ecocardiograma transtorácico é limitada nos pacientes que recebem ventilação mecânica, o ecocardiograma transesofágico pode auxiliar na confirmação da RVFV.
RMRI proporciona qualidade de imagem superior e permite a identificação do local e anatomia de um pseudoaneurisma ventricular (ou seja, ruptura do VE contido pelo pericárdio com coágulo fechado). Entretanto, a RM é de uso limitado no cenário agudo, devido ao tempo envolvido e nãoportabilidade das unidades de imagem.
Tratamento do VFWR
A estratégia de prevenção mais importante é a terapia de reperfusão precoce, sendo a intervenção coronariana percutânea (ICP) a modalidade preferida. A terapia fibrinolítica está associada à diminuição geral do risco de RVFV; entretanto, seu uso mais de 14 horas após o início da STEMI pode aumentar o risco de ruptura precoce.
O tratamento padrão para VFWR é a correção cirúrgica de emergência após a estabilidade hemodinâmica ser alcançada. Os pacientes podem necessitar primeiro de líquidos intravenosos, inotrópicos e pericardiocentese de emergência.
Pifarré e associados recomendaram a implantação de uma bomba de balão intra-aórtica para diminuir a pós-carga sistólica e melhorar a perfusão miocárdica diastólica.
Técnicas cirúrgicas transversais têm sido aplicadas, incluindo infarctectomia, aderindo com adesivos biológicos feitos de fibra de poliéster tereftalato de polietileno (Dacron; DuPont, Wilmington, DE) ou resina fluoropolímero de politetrafluoroetileno (Teflon; DuPont); e o uso de suturas em penhor sem infarctectomia.
A taxa de mortalidade é significativamente alta e depende em grande parte do estado hemodinâmico pré-operatório do paciente. O diagnóstico precoce, a rápida instituição das medidas descritas acima para alcançar a estabilidade hemodinâmica e a rápida correção cirúrgica podem melhorar as taxas de sobrevida. O seguimento do estudo randomizado Acorn demonstrou melhora a longo prazo na estrutura e função ventricular esquerda após cirurgia da valva mitral por até 5 anos. Esses dados fornecem evidências que suportam a correção da valva mitral em combinação com o dispositivo Acorn CorCap para pacientes com insuficiência cardíaca não isquêmica com disfunção ventricular esquerda grave, que foram otimizados medicamente, mas permanecem sintomáticos com regurgitação mitral significativa.
Ruptura do septo ventricular
VSR é uma complicação pouco freqüente, porém com risco de vida, do IAM. Apesar do tratamento médico e cirúrgico ideal, os pacientes com RVSR têm uma alta taxa de mortalidade intra-hospitalar. Durante a era pré-trombolítica, os RVSRs ocorreram em 1-3% dos indivíduos com IAM. A incidência diminuiu com a terapia trombolítica (para 0,2-0,34%) devido à melhora na reperfusão e no resgate miocárdico. A distribuição bimodal da RVS é caracterizada por uma alta incidência nas primeiras 24 horas, com outro pico nos dias 3-5 e raramente mais de 2 semanas após o IAM.
Em pacientes que receberam trombolíticos, o tempo médio desde o início dos sintomas do IAM até a ruptura septal foi de 1 dia no ensaio Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries (GUSTO-I) e 16 horas no ensaio Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock? (SHOCK).
Os fatores de risco para ruptura septal incluem idade avançada (>65 anos), sexo feminino, doença de vaso único, IM extensa, e má circulação colateral septal. Antes do advento dos trombolíticos, hipertensão e ausência de história de angina eram fatores de risco para RVS. Tamanho do infarto extenso e envolvimento do VD são outros fatores de risco conhecidos para ruptura do septo.
Em pacientes com IAM sem reperfusão, a necrose da coagulação desenvolve-se dentro de 3-5 dias após o infarto. Os neutrófilos migram para a zona necrótica e sofrem apoptose, liberam enzimas líticas e apressam a desintegração do miocárdio necrótico. Alguns pacientes têm infartos com grandes hematomas intramurais, que se dissecam no tecido e resultam em ruptura septal precoce. O tamanho da ruptura septal varia de alguns milímetros a vários centímetros.
VSR é categorizado como simples ou complexo, dependendo do seu comprimento, curso e localização. Na ruptura septal simples, a perfuração está no mesmo nível em ambos os lados do septo, e uma comunicação direta através do septo está presente em todo o septo. Uma ruptura septal complexa é caracterizada por hemorragia extensa com traços serpiginosos irregulares no tecido necrótico.
Ruptura septal é mais comum em pacientes com grandes IM anteriores devido à oclusão da artéria ADA, causando infartos septal extensos. Esses infartos estão associados a elevações do segmento ST e ondas Q em eletrodos inferiores (II, III, aVF) e, portanto, essas alterações do ECG são mais comumente vistas nas rupturas septal. Essas rupturas são geralmente apicais e simples.
Rupturas septais em pacientes com IM inferior ocorrem com relativa freqüência. Estas rupturas envolvem o septo inferoposterior basal e são frequentemente complexas.
Apresentação clínica do VSR
Sintomas do VSR complicando o IAM incluem dor torácica, falta de ar, hipotensão, falha biventricular e choque dentro de horas a dias. Os pacientes frequentemente apresentam um novo sopro holosistólico, alto e severo. Este sopro é mais alto ao longo da borda inferior esquerda do esterno e está associado a uma emoção sistólica paraesternal palpável. Galopes VD e VE S3 são comuns.
Em pacientes com choque cardiogênico complicando a ruptura septal, o sopro e a emoção podem ser difíceis de identificar. Em contraste, pacientes com RM aguda frequentemente apresentam um sopro sistólico suave no ápice sem emoção.
Diagnóstico do VSR
Equocardiografia com Doppler colorido é a ferramenta diagnóstica de escolha para a identificação de um VSR. (Veja a imagem abaixo.) Sua sensibilidade e especificidade foram relatadas como sendo de até 100%. Além disso, ele pode ser usado para o seguinte:
-
Definir o local e tamanho da ruptura septal
-
Avaliar o VE e o VR função
-
Estimar a pressão sistólica do VD
-
Quantificar a esquerda-shunt para a direita
Cateterismo cardíaco é geralmente necessário para confirmar o diagnóstico, quantificar o grau de shunt esquerda-direita, diferenciar o RVS de outras condições (por exemplo, regurgitação mitral), além de visualizar as artérias coronárias.
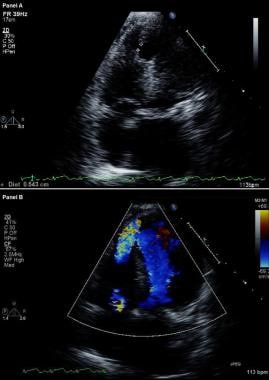 Complicações do Infarto do Miocárdio. Ecocardiograma bidimensional (superior) modificado e imagem Doppler de fluxo colorido (inferior). Vistas apicais de quatro câmaras mostram uma ruptura no septo interventricular e comunicação livre entre os ventrículos através de um grande defeito do septo apical ventricular em um paciente que teve recentemente um infarto do miocárdio anterior.
Complicações do Infarto do Miocárdio. Ecocardiograma bidimensional (superior) modificado e imagem Doppler de fluxo colorido (inferior). Vistas apicais de quatro câmaras mostram uma ruptura no septo interventricular e comunicação livre entre os ventrículos através de um grande defeito do septo apical ventricular em um paciente que teve recentemente um infarto do miocárdio anterior. Em pacientes com RVS, a cateterização do coração direito mostra um aumento na saturação de oxigênio do átrio direito para o VD; em contraste, não ocorre aumento na saturação de oxigênio entre os pacientes com RM. A presença de grandes ondas V no traçado da cunha capilar pulmonar suporta o diagnóstico de RM aguda grave.
Ventriculografia esquerda também pode ser usada para identificar o local de ruptura ventricular (ver Cateterismo cardíaco ). Entretanto, este estudo geralmente é desnecessário após um exame ecocardiográfico e doppler de boa qualidade.
Tratamento da RVSVD
A chave para o manejo da RVSVD é o diagnóstico imediato e uma abordagem agressiva para estabilização hemodinâmica, angiografia e cirurgia. A abordagem ideal inclui a estabilização hemodinâmica com a administração de oxigênio e suporte mecânico com o uso de uma bomba balão intra-aórtica, bem como a administração de vasodilatadores (para reduzir a pós-carga e, portanto, a pressão do VE e a derivação da esquerda para a direita), diuréticos e agentes inotrópicos.
Cateterismo cardíaco é necessário para definir a anatomia coronariana, seguido de correção cirúrgica urgente.
Em um estudo de 52 pacientes consecutivos com ruptura do septo ventricular pós-infarto que foi reparado cirurgicamente, os investigadores constataram que a mortalidade em 30 dias foi de 36% (n = 19). A maioria dos pacientes que sobreviveram por menos de 30 dias teve um estado de choque pré-operatório. Os investigadores concluem que, para pacientes com ruptura do septo ventricular, a melhora do estado de choque pré-operatório e a revascularização coronária agressiva são necessárias.
A terapia medicamentosa destina-se apenas à estabilização temporária antes da cirurgia, pois a maioria dos pacientes deteriora-se rapidamente e morre na ausência de intervenção cirúrgica. No ensaio GUSTO-I, a taxa de mortalidade em 30 dias foi menor em pacientes com RVS que foram submetidos à correção cirúrgica do que em pacientes tratados clinicamente (47% vs 94%), assim como a taxa de mortalidade em 1 ano (53% vs 97%). Lemery et al relataram uma taxa de sobrevida em 30 dias de 24% em pacientes tratados medicamente, comparado com 47% naqueles tratados cirurgicamente.
Diretrizes do American College of Cardiology/American Heart Association (ACC/AHA) para o tratamento de pacientes com ruptura septal complicando o IAM destacam a intervenção cirúrgica urgente, independentemente do seu estado clínico. O tratamento cirúrgico da ruptura septal inclui os seguintes elementos:
-
Pronta instalação de circulação extracorpórea hipotérmica
-
Uma abordagem da ruptura septal através da área de infarto e a excisão de todas as margens necróticas, friáveis do septo e das paredes ventriculares para evitar hemorragia pós-operatória, defeito septal residual, ou ambos
-
Reconstrução do septo e das paredes ventriculares, utilizando material protético e preservação da configuração geométrica dos ventrículos e função cardíaca
Fechamento percutâneo da ruptura septal é uma abordagem relativamente nova, utilizada em pacientes selecionados como alternativa ao reparo cirúrgico ou para a estabilização aguda de pacientes críticos. Entretanto, o fechamento percutâneo não está atualmente disponível em muitas instituições, e não há dados de resultados a longo prazo disponíveis.
Estudos transversais não mostraram relação entre mortalidade perioperatória e revascularização coronariana concomitante (revascularização do miocárdio). Os pacientes com choque cardiogênico devido à ruptura do septo têm o pior desfecho. No estudo SHOCK, a mortalidade intra-hospitalar foi maior em pacientes com choque cardiogênico devido à ruptura septal (87,3%) do que em pacientes com choque cardiogênico por todas as outras causas (59,2% com insuficiência ventricular esquerda pura e 55,1% com RM aguda).
Em pacientes que sobrevivem à correção cirúrgica, a taxa de defeito septal recorrente ou residual é relatada em cerca de 28%, e a mortalidade associada é alta.
Intervenção cirúrgica de repetição é indicada em pacientes com insuficiência cardíaca clínica ou fração sistêmico-pulmonar maior que 2.
Regurgitação mitral aguda
RMR é uma complicação comum do IAM que resulta da remodelação local e global do VE e que é um preditor independente de insuficiência cardíaca e morte. A RM normalmente ocorre 7-10 dias após um IAM, embora esse início possa variar de acordo com o mecanismo da RM. A ruptura do músculo papilar resultando em RM ocorre dentro de 1-14 dias (mediana, 1 d).
Mild-to-moderate MR é freqüentemente clinicamente silenciosa e detectada no ecodopplercardiograma realizado durante a fase inicial do IAM. Nesses casos, a RM raramente causa comprometimento hemodinâmico.
Rastreamento cervical e ecocardiograma tridimensional demonstraram ser ferramentas de imagem importantes na avaliação do remodelamento reverso do VE após cirurgia de regurgitação mitral degenerativa. Sutis alterações regionais pré-operatórias sutis na função diastólica da parede septal e lateral poderiam ser identificadas no pré-operatório, auxiliando na otimização do tempo de referência e reconhecendo potenciais culpados como indicadores de recorrência da doença após a plastia mitral.
Ressonância magnética aguda severa que resulta da ruptura dos músculos papilares ou cordas tendíneas resulta em deterioração hemodinâmica abrupta com choque cardiogênico. O diagnóstico rápido, a estabilização hemodinâmica e a intervenção cirúrgica imediata são necessários porque a RM aguda grave está associada a uma alta taxa de mortalidade.
A incidência relatada de RM pode variar devido a vários fatores, incluindo os métodos diagnósticos utilizados, a presença ou ausência de insuficiência cardíaca, o grau de RM relatado, o tipo de terapia aplicada e o tempo desde o início do infarto até o teste.
Durante o ensaio GUSTO-I, a incidência de RM em pacientes que receberam terapia trombolítica foi de 1,73%. O estudo SHOCK, que incluiu pacientes com IM que apresentaram choque cardiogênico, observou uma incidência de 39,1% de RM moderada a grave. Kinn et al relataram que a reperfusão com angioplastia resultou em uma diminuição de 82% na taxa de RM aguda, em comparação com a terapia trombolítica (0,31% vs 1,73%).
Os fatores de risco para RM são idade avançada, sexo feminino, grande infarto, IAM prévio, isquemia recorrente, doença coronariana multivascular e insuficiência cardíaca.
Os mecanismos transversais podem causar RM após IAM. Ruptura do músculo papilar é o mecanismo mais comumente relatado.
Tal ruptura ocorre em 1% dos pacientes com IAM e freqüentemente envolve o músculo papilar póstero-medial ao invés do músculo papilar ântero-lateral, já que o primeiro tem um único suprimento de sangue versus o suprimento duplo para o segundo. A ruptura do músculo papilar pode levar à descamação ou prolapso das cúspides, resultando em RM severa. A disfunção do músculo papilar devido à cicatrização ou isquemia recorrente pode também levar à RM nas fases subagudas e crônicas após a IM; esta condição pode se resolver espontaneamente.
Infartos posteriores grandes produzem RM aguda devido à dilatação anular assimétrica e função e geometria alteradas do músculo papilar.
Apresentação clínica da RM
Patientes com RM funcional leve ou moderada são freqüentemente assintomáticos. A gravidade dos sintomas varia de acordo com a função ventricular. As características clínicas da RM aguda grave incluem falta de ar, fadiga, um novo sopro apical holossistólico, edema pulmonar com flash e choque.
O novo sopro sistólico pode ser apenas sistólico de início a meio, e não holossistólico. Pode ser mole ou mesmo ausente devido ao aumento abrupto da pressão atrial esquerda, que diminui o gradiente pressórico entre o átrio esquerdo e o VE, em comparação com a RM crônica. O murmúrio é melhor ouvido no ápice do que na borda inferior do esterno esquerdo, e está incomumente associado a uma emoção. São esperados galopes S3 e S4.
Diagnóstico da RM
O clínico não pode contar com um novo sopro holossistólico para diagnosticar a RM ou avaliar sua gravidade devido à variável estado hemodinâmico. Em um paciente com IAM que apresenta um novo sopro sistólico apical, edema agudo de pulmão e choque cardiogênico, um alto índice de suspeita clínica de RM grave é a chave do diagnóstico.
A radiografia de tórax pode mostrar evidência de edema pulmonar no quadro agudo sem aumento cardíaco clinicamente significativo.
A ecocardiografia com imagem Doppler colorida é a ferramenta diagnóstica padrão para detecção de RM. O ecocardiograma transtorácico é a ferramenta de triagem inicial preferencial, mas o ecocardiograma transesofágico é inestimável na definição da gravidade e do mecanismo exato da RM aguda, especialmente quando a suspeita de ruptura do músculo papilar é alta. O cateterismo cardíaco deve ser realizado em todos os pacientes para determinar a extensão e a gravidade da doença arterial coronariana.
Tratamento da RM
Determinação da estabilidade hemodinâmica, elucidação do mecanismo exato da RM aguda e terapia oportuna são todos necessários para um resultado favorável. O tratamento médico inclui a redução da carga com o uso de diuréticos, nitroprussiato de sódio e nitratos em pacientes que não são hipotensos.
Em pacientes que têm comprometimento hemodinâmico, a contrapulsação intra-aórtica por balão deve ser implantada rapidamente. Esta intervenção geralmente reduz substancialmente a pós-carga e o volume regurgitante, melhorando o débito cardíaco na preparação para o reparo cirúrgico. Sem o reparo cirúrgico, a terapia médica isolada em pacientes com ruptura do músculo papilar resulta em melhora hemodinâmica inadequada e um mau prognóstico a curto prazo.
Intervenção cirúrgica de emergência é o tratamento de escolha para a ruptura do músculo papilar. As abordagens cirúrgicas podem incluir a plastia ou substituição da valva mitral. Na ausência de necrose do músculo papilar, a plastia mitral melhora mais a sobrevida do que a troca da valva mitral. Esta diferença é porque o aparelho subvalvar é geralmente preservado. A plastia valvar mitral também elimina complicações relacionadas ao mau funcionamento da prótese.
Em pacientes com necrose extensa do músculo papilar e/ou parede livre ventricular, a troca valvar mitral é a modalidade preferida. A revascularização do miocárdio (RM) realizada no momento da cirurgia foi demonstrada em um estudo para melhorar a sobrevida a curto e longo prazo.
A única situação em que a cirurgia de emergência pode ser evitada com segurança é no caso de RM intermitente devido a isquemia recorrente. Nesses pacientes, a revascularização miocárdica bem sucedida pode ser eficaz. Este procedimento é realizado por meio de angioplastia ou revascularização do miocárdio.
OVSVE dinâmica
Pensa-se que esteja presente apenas na cardiomiopatia hipertrófica, vários investigadores têm relatado a presença da VSVE dinâmica como uma complicação da IM anterior aguda. A presença da VSVE dinâmica também tem sido postulada como uma das etiologias para a ruptura miocárdica.
A VSVE dinâmica é mecanicamente causada por hipercinesia compensatória dos segmentos basal e médio do VE em pacientes com infarto distal da ADA. Os preditores de aumento do movimento da parede regional em zonas não-infarto são a ausência de doença multivasiva, sexo feminino e maior fluxo no vaso relacionado ao infarto. O aumento da força contrátil do miocárdio basal causa regurgitação mitral através do efeito do Venturi. Isso resulta no aumento da OTO, levando a uma maior redução do débito do VE no quadro de hipoperfusão sistêmica já presente.
Esse aumento da OTOVE no quadro de miocárdio transmural danificado forma um quadro perfeito no qual há aumento da pressão intraventricular sistólica final, o que induz ao aumento da tensão da parede da zona enfraquecida do infarto necrótico. Esta complicação frequentemente fatal ocorre mais freqüentemente em mulheres, pacientes mais velhas (>70 anos) e aquelas sem IM prévia.
Apresentação clínica da VSVE
As pacientes afetadas podem ter os sintomas usuais de um complexo de sintomas autonômicos aumentado, como angústia respiratória, diaforese e extremidades frias e úmidas, além dos sinais e sintomas típicos do IAM.
Esses pacientes podem evoluir rapidamente para choque cardiogênico com ortopnéia grave, dispnéia e oligúria, e podem ter estado mental alterado pela hipoperfusão cerebral. Os pacientes podem apresentar um novo sopro sistólico de ejeção, um novo sopro holossistólico irradiando para a axila como resultado do movimento sistólico anterior (SAM) da cúspide mitral. Um galope S3, estertores pulmonares, hipotensão e taquicardia também podem estar presentes; estes últimos sinais físicos podem estar completamente ausentes no quadro agudo.
O ecocardiograma transtorácico ou transesofágico (TTE/TEE) é o teste diagnóstico de escolha e pode caracterizar com precisão o segmento hipercinético, a VSVE e o folheto mitral SAM.
Tratamento da VSVE
Considerando reduzir a hipercontratilidade do miocárdio através da adição cuidadosa de betabloqueio. Também a reanimação lenta do volume por aumento de pós-carga (fenileferina) pode aumentar a pré-carga e diminuir a VSVE e SAM. Seria melhor evitar medicações de pós-augmentação. Vasodilatadores, inotropos e bombas de balão também devem ser evitados porque podem aumentar a VSVE.
Falha do VD
Muitas vezes visto no ajuste da IM inferior, disfunção leve do VD pós-MI é comum; entretanto, na maioria dos casos o efeito sobre o VE é mínimo.
Hipocinesia significativa do VD ocorre quando há oclusão proximal da artéria coronária direita com pouca colateral da circulação do lado esquerdo. Postula-se que, como o VD tem parede fina e menor demanda de oxigênio, há perfusão coronariana durante todo o ciclo cardíaco; portanto, o infarto irreversível generalizado é raro.
Insuficiência típica do VD pode apresentar hipotensão (devido à falta de pré-carga do VE) e distensão venosa jugular com campo pulmonar claro. Embora classicamente descrita no cenário de falha do VD, esta tríade raramente é vista em sua forma pura no cenário clínico. A maioria dos pacientes apresenta choque cardiogênico de baixo débito ou insuficiência do VE com sintomas autonômicos associados.
A presença de pressão venosa jugular acima de 8 cm H2O e sinal de Kussmaul é altamente sensível e específica para insuficiência grave do VD.
Ocasionalmente, o desvio da direita para a esquerda através de um forame oval patente causa hipoxemia persistente. Tenha em mente esta complicação peculiar.
Electrocardiograficamente, pacientes apresentam elevação inferior do ST em conjunto com elevação do ST no eletrodo do V4R. A radiografia de tórax geralmente aparece suave, sem distensão venosa do lobo superior.
Diagnóstico de falha do VD
Equocardiografia bidimensional (2D) e ressonância magnética (RM) são muito úteis. Na maioria das vezes, o ecocardiograma ajudará a confirmar o diagnóstico.
Os achados do cateterismo dewan-Ganz são geralmente sugestivos de altas pressões de AR com uma PCWP baixa.
Tratamento de falha do VD
Reanimação do volume para manter a PCWP em ou em torno de 15 mmHg poderia ajudar a temporizar, aumentando transitoriamente a pré-carga do VD. Embora o tratamento definitivo envolva o restabelecimento da circulação coronariana. Em casos raros de falha grave do VD, deve-se considerar o suporte circulatório mecânico utilizando dispositivos de assistência ao VD (DA), seja temporariamente ou como terapia em ponte, no contexto de envolvimento biventricular extenso.