Propriedades Físicas dos Compostos Iônicos vs. Covalentes
Em geral, compostos iônicos e covalentes têm propriedades físicas diferentes. Os compostos iônicos formam sólidos cristalinos duros que derretem a altas temperaturas e são resistentes à evaporação. Estas propriedades derivam da estrutura interna característica de um sólido iônico, ilustrada esquematicamente na parte (a) da Figura 2.7.4 que mostra a matriz tridimensional de íons alternados positivos e negativos mantidos juntos por fortes atrações eletrostáticas. Em contraste, como mostrado na parte (b) da Figura 9.5.1, a maioria dos compostos covalentes consiste em moléculas discretas mantidas juntas por forças intermoleculares comparativamente fracas (as forças entre moléculas), mesmo que os átomos dentro de cada molécula sejam mantidos juntos por fortes ligações intramoleculares covalentes (as forças dentro da molécula). As substâncias covalentes podem ser gases, líquidos ou sólidos à temperatura e pressão ambiente, dependendo da força das interações intermoleculares. Os sólidos moleculares covalentes tendem a formar cristais moles que derretem a baixas temperaturas e evaporam facilmente.
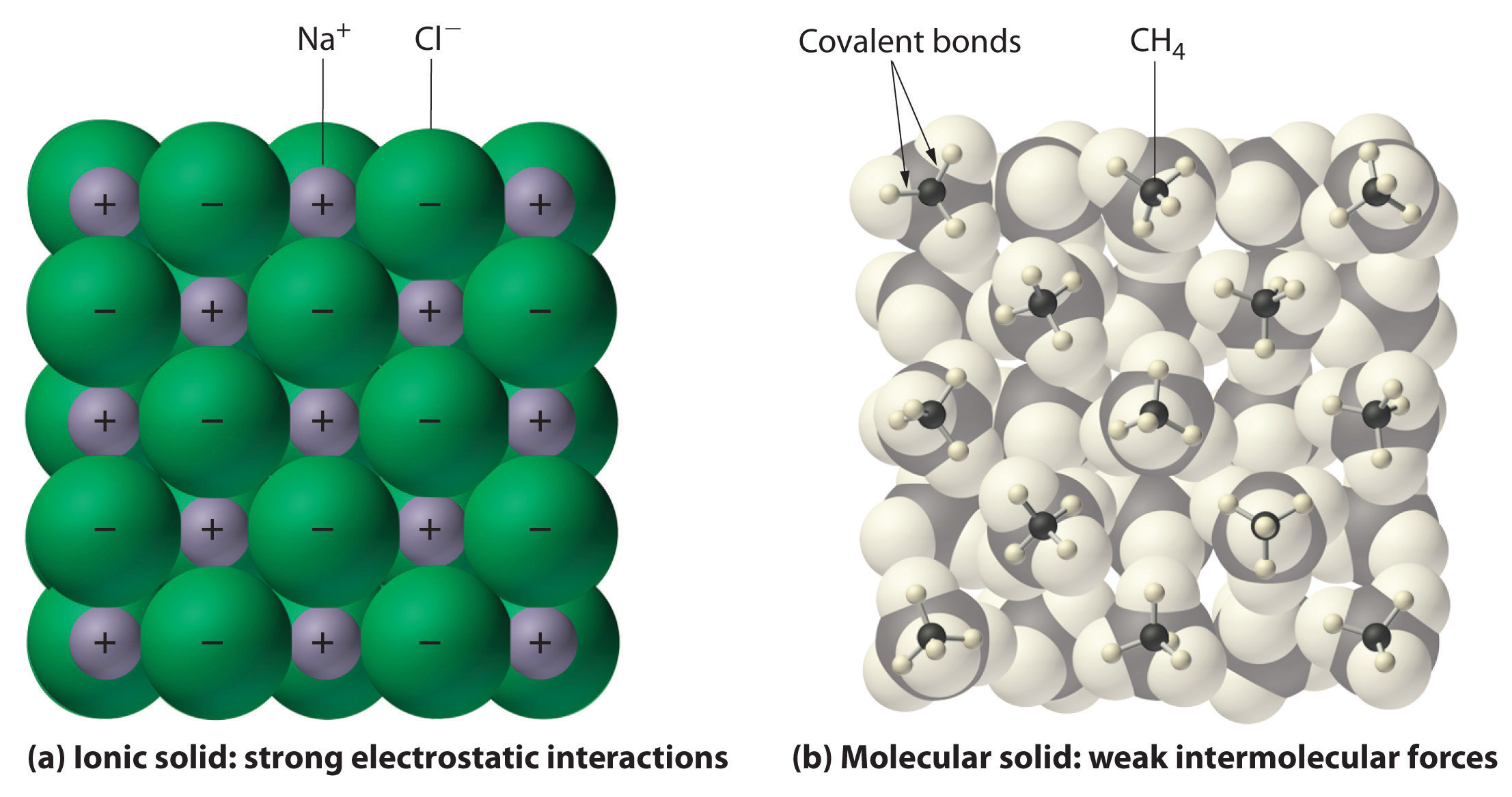
Figure 9.5.1: Interacções em Sólidos Iónicos e Covalentes. (a) Os íons carregados positiva e negativamente em um sólido iônico como o cloreto de sódio (NaCl) são mantidos juntos por fortes interações eletrostáticas. (b) Nesta representação da embalagem de moléculas de metano (CH_4) em sólido metano, um sólido molecular prototípico, as moléculas de metano são mantidas juntas no sólido apenas por forças intermoleculares relativamente fracas, mesmo que os átomos dentro de cada molécula de metano sejam mantidos juntos por fortes ligações covalentes.
Hidrocarbonetos
Sólidos moleculares consistem em átomos ou moléculas mantidas entre si por interacções dipolo/dipolo, forças de dispersão de Londres, ou ligações de hidrogénio, ou qualquer combinação destas. A disposição das moléculas em benzeno sólido é a seguinte:

Figure 9.5.2: A estrutura do benzeno sólido. No benzeno sólido, as moléculas não estão dispostas com seus planos paralelos entre si, mas em ângulos de 90°.
Porque as interações intermoleculares em um sólido molecular são relativamente fracas comparadas com as ligações iônicas e covalentes, os sólidos moleculares tendem a ser macios, de baixa fusão e facilmente vaporizados (ΔH_{fus}} e {vap}} são baixos). Para substâncias similares, a força das forças de dispersão de Londres aumenta suavemente com o aumento da massa molecular. Por exemplo, os pontos de fusão do benzeno (C6H6), naftaleno (C10H8) e antraceno (C14H10), com um, dois e três anéis aromáticos fundidos, são 5,5°C, 80,2°C e 215°C, respectivamente. Os entalpias de fusão também aumentam suavemente dentro da série: benzeno (9,95 kJ/mol) < naftaleno (19,1 kJ/mol) < antraceno (28,8 kJ/mol). Se as moléculas têm formas que não podem se agrupar eficientemente no cristal, então os pontos de fusão e as entalpias de fusão tendem a ser inesperadamente baixos porque as moléculas são incapazes de se organizar para otimizar as interações intermoleculares. Assim o tolueno (C6H5CH3) e o m-xileno têm pontos de fusão de -95°C e -48°C, respectivamente, que são significativamente inferiores ao ponto de fusão do análogo mais leve, mas mais simétrico, o benzeno.
Aborracha auto-regenerativa é um exemplo de um sólido molecular com potencial para aplicações comerciais significativas. O material pode se esticar, mas quando quebrado em pedaços pode se unir novamente através do restabelecimento de sua rede de ligação de hidrogênio sem mostrar qualquer sinal de fraqueza. Entre outras aplicações, ele está sendo estudado para seu uso em adesivos e pneus de bicicleta que se auto-cura.

Figure 9.5.3: Tolueno e m-xileno. Os grupos metilo ligados ao anel de fenileno em tolueno e m-xileno evitam que os anéis se empacotem juntos, bem como em benzeno sólido.