24-6C Reacções de Compostos Nitro
Os compostos nitro são bastante instáveis no sentido termodinâmico; por exemplo, o calor de decomposição do nitrometano, de acordo com a seguinte estequiometria, é \(67.4 \: \texto{kcal mol}^{-1}).
Vantagem das energias consideráveis e das rápidas taxas de reacções como esta no uso comercial de compostos nitrosos como explosivos. Com alguns compostos nitrosos, como o TNT, há uma vantagem adicional de baixa sensibilidade ao choque.
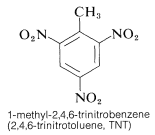
TNT não é detonado facilmente por simples impacto e até queima sem explodir. No entanto, uma vez iniciada a detonação, a decomposição é propagada rapidamente. As características de razoável estabilidade de manuseio e alto potencial termodinâmico tornam os compostos nitrosos particularmente úteis. Outros compostos polinitros úteis como explosivos incluem PETN (Secção 17-3C), ciclonite (Secção 16-4C), ácido pícrico e tetrilo:
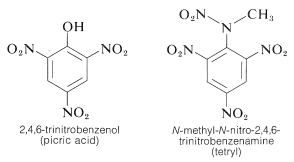
Uma característica importante dos compostos polinitros aromáticos é a sua capacidade de formar complexos de “transferência de carga” com hidrocarbonetos aromáticos, especialmente aqueles que são substituídos por grupos alquílicos. Os complexos de 2,4,6-trinitrobenzenol (ácido pícrico) e hidrocarbonetos aromáticos são frequentemente sólidos cristalinos, úteis para a separação, purificação e identificação de hidrocarbonetos aromáticos. Estas substâncias são chamadas de “picratos de hidrocarbonetos”, mas o nome é enganador porque na realidade não são sais. Além disso, complexos semelhantes são formados entre hidrocarbonetos aromáticos e trinitrobenzeno, o que demonstra que os grupos nitrosos, e não o grupo hidroxila, são essenciais para a formação de complexos. A ligação nestes complexos assemelha-se à dos complexos de halogéneos com alcenos e benzeno (Secções 22-4D e 10-3C) e resulta de forças atractivas entre substâncias ricas em electrões e substâncias pobres em electrões. O nome descritivo – complexo de transferência de carga – sugere que o complexo tem estruturas VB envolvendo a transferência de um elétron da molécula doadora (rica em elétrons) para a molécula do aceitador (pobre em elétrons). O nome complexo \pi também é usado porque, geralmente, pelo menos um componente do complexo tem um sistema elétron. Complexos de transferência de carga ou complexos entre compostos polinitros e hidrocarbonetos aromáticos parecem dar estruturas tipo sanduíche com os anéis aromáticos em planos paralelos, embora não necessariamente centrados exatamente uns sobre os outros:
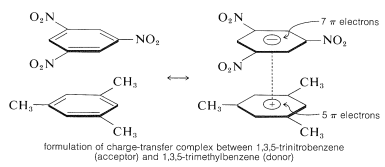
Os complexos de transferência de carga são quase sempre mais coloridos do que os seus componentes individuais. Um exemplo espetacular é o benzeno e o tetracanoeteno, cada um dos quais separadamente é incolor, mas que dão um complexo de cor laranja brilhante quando misturados. Uma mudança para comprimentos de onda de absorção mais longos, relativos aos seus componentes, é de esperar para complexos de transferência de carga, devido à maior possibilidade de estabilização do estado excitado através da deslocalização de electrões envolvendo ambos os componentes.
Redução de compostos nitrosos ocorre prontamente com uma variedade de agentes redutores e tais reduções proporcionam uma síntese particularmente útil de aminas aromáticas (Seção 23-12B):
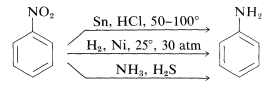
A redução de um composto nitro para uma amina requer seis equivalentes de agente redutor:
Um não esperaria que tal redução ocorresse em uma única etapa. Na verdade, a redução é gradual e procede através de uma série de intermediários, que, com agentes redutores fortes em solução ácida, têm no máximo uma existência transitória. Os intermediários formados sucessivamente a partir de azanóis (hidroxilaminas), (RNO_2) por incrementos de dois equivalentes de agente redutor são compostos nitrosos, (R-N=O), e azanóis substituídos (hidroxilaminas), (RNHOH):
3975
3975>3975). \ce{RN=O} \esquerda \ce{RNHOH} \underset{-\ce{H_2O}}{\overset{2 \left}{\longrightarrow}} \{RNH_2}]
Que os azanóis subtituídos de aryl podem ser obtidos directamente dos compostos nitrosos correspondentes com solução de zinco e cloreto de amónio. No entanto, o zinco e o ácido clorídrico dão a amina:
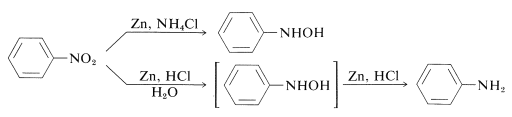
A diferença entre estas reacções está nas taxas de redução associadas com a acidez da solução. O cloreto de amónio é um ácido muito mais fraco do que o cloreto de amónio; o pH das soluções de cloreto de amónio é cerca de 6,
>
Oxidação dos isoarilazanóis sob condições controladas produz compostos nitrosos. Esta reacção não é diferente da oxidação dos álcoois em cetonas (Secção 15-6B):
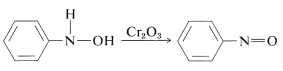
Redução de compostos de nitroglicerina arilo com agentes redutores menos potentes, especialmente em meios alcalinos, dá o que pode parecer um misterioso conglomerado de produtos redutores bimoleculares. Por exemplo, com nitrobenzeno,
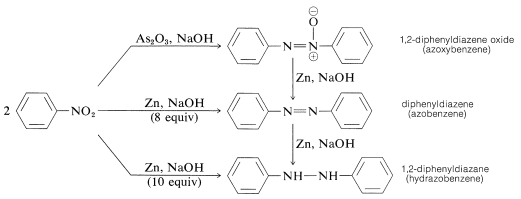
Todas estas substâncias podem ser reduzidas a benzenamina com estanho e ácido clorídrico. Como resultado, cada uma poderia ser, mas não necessariamente é, um intermediário na redução de compostos nitrosos a aminas. A formação dos produtos de redução bimolecular é o resultado de reacções induzidas pela base entre compostos nitrosos e azanóis ou aminas e possivelmente uma maior redução das substâncias inicialmente produzidas.
Os derivados polinitrobenzenoseverais têm utilizações herbicidas importantes. Exemplos são: {\ce{N}^3}, {\ce{N}^3}-dietil-6-trifluorometil-2,4-dinitro-1,3-benzenodiamina e {\ce{N},{\ce{N})-dipropil-4-trifluorometil-2,6-dinitrobenzenamina:
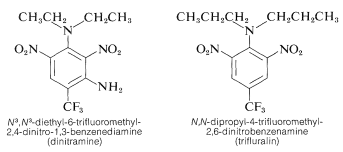
Estas substâncias quando misturadas com o solo matam as plantas daninhas mas não as plantas cultivadas como o algodão, a soja e o amendoim. A actividade é elevada; normalmente apenas cerca de 0,08: Para um bom controlo das ervas daninhas é necessário um texto (g m^^^).
As reacções mais importantes dos nitroalcanos são as que envolvem os hidrógénios dos compostos primários e secundários. Por exemplo, o nitrometano é suficientemente ácido para se dissolver em soluções aquosas de hidróxidos. O ânion assim produzido tem uma estrutura electrónica análoga à do ânion nitrato:
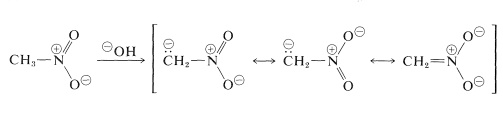
Uma propriedade interessante deste íon é que quando as soluções do mesmo são acidificadas, produz-se um isómero instável, bastante ácido do nitrometano (chamado forma aci), que lentamente reverte para a forma mais estável do nitroglicerol:
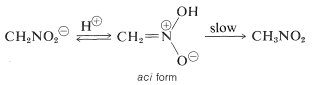
Mudanças semelhantes ocorrem na acidificação do sal de enol de um composto carbonilo, sendo a principal diferença a vida muito mais longa do composto aci-nitro comparado com a de um enol de uma cetona simples (ver secção 17-1B).
Os compostos de nitroglicerina primários e secundários são submetidos a adições de aldol e Michael com compostos carbonílicos e catalisadores básicos adequados:
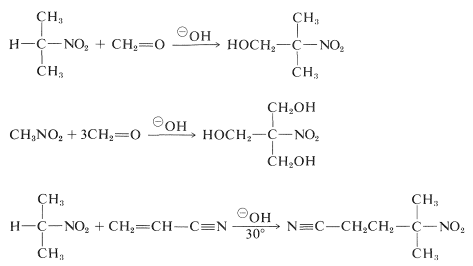
Felizmente, reacções de alquilação análogas à alquilação base-catalizada dos compostos carbonílicos geralmente não são úteis para a síntese de compostos nitrosos superiores, porque a alquilação das bases conjugadas dos compostos nitrosos primários é mais lenta que a alquilação.