Objetivos de aprendizagem
- Para definir e dar exemplos dos principais tipos de radioatividade.
Os átomos são compostos de partículas-protões subatômicos, nêutrons e elétrons. Prótons e nêutrons estão localizados no núcleo e fornecem a maior parte da massa do átomo, enquanto elétrons circundam o núcleo em conchas e sub-conchas e são responsáveis pelo tamanho de um átomo. Lembre-se, a notação para representar sucintamente um isótopo de um determinado átomo:
O elemento neste exemplo, representado pelo símbolo C, é o carbono. Seu número atômico, 6, é o subscrito inferior esquerdo sobre o símbolo e é o número de prótons no átomo. O número de massa, o subscrito superior esquerdo do símbolo, é a soma do número de prótons e nêutrons no núcleo deste isótopo em particular. Neste caso, o número de massa é 12, o que significa que o número de nêutrons no átomo é 12 – 6 = 6 (ou seja, o número de massa do átomo menos o número de prótons no núcleo é igual ao número de nêutrons). Ocasionalmente, o número atómico é omitido nesta notação porque o símbolo do próprio elemento transmite o seu número atómico característico. Os dois isótopos de hidrogênio, 2H e 3H, recebem seus próprios nomes: deutério (D) e trítio (T), respectivamente. Outra forma de expressar um isótopo particular é listar o número de massa após o nome do elemento, como carbono-12 ou hidrogênio-3,
A teoria atômica no século XIX presumiu que os núcleos tinham composições fixas. Mas em 1896, o cientista francês Henri Becquerel descobriu que um composto de urânio colocado perto de uma placa fotográfica fazia uma imagem na placa, mesmo que o composto estivesse envolto em um pano preto. Ele argumentou que o composto de urânio estava emitindo algum tipo de radiação que passava através do pano para expor a placa fotográfica. Outras investigações mostraram que a radiação era uma combinação de partículas e raios electromagnéticos, com a sua fonte final como o núcleo atómico. Essas emanações foram chamadas, coletivamente, radioatividade.
Existem três formas principais de emissões radioativas. A primeira é chamada de partícula alfa, que é simbolizada pela letra grega α. Uma partícula alfa é composta por dois prótons e dois nêutrons, e portanto é a mesma que um núcleo de hélio. (Usamos muitas vezes a letra grega 4 para representar uma partícula alfa). Tem uma carga de 2+. Quando um átomo radioativo emite uma partícula alfa, o número atômico original do átomo diminui em dois (por causa da perda de dois prótons), e seu número de massa diminui em quatro (por causa da perda de quatro partículas nucleares). Podemos representar a emissão de uma partícula alfa com uma equação química – por exemplo, a emissão de partícula alfa de urânio-235 é a seguinte:
>
Como sabemos que um produto da reação é {^{231}_{90}Th})? Nós usamos a lei da conservação da matéria, que diz que a matéria não pode ser criada ou destruída. Isto significa que devemos ter o mesmo número de prótons e neutrões em ambos os lados da equação química. Se o nosso núcleo de urânio perder 2 prótons, restam 90 prótons, identificando o elemento como tório. Além disso, se perdermos 4 partículas nucleares dos 235 originais, restam 231. Assim, usamos a subtracção para identificar o isótopo do átomo de tório – neste caso, {^{231}_{90}Th}}).
Os químicos usam frequentemente os nomes isótopo pai e isótopo filha para representar o átomo original e o produto que não seja a partícula alfa. No exemplo anterior, {{^{235}_{92}U}) é o isótopo pai, e {^{231}_{90}Th}}) é o isótopo filha. Quando um elemento muda para outro desta forma, ele sofre um decaimento radioativo.
Exemplo {\i1}(PageIndex{\i}{\i1}): Radon-222
Escreva a equação nuclear que representa o decaimento radioativo do radônio-222 por emissão de partículas alfa e identifique o isótopo filha.
Solução
Radon tem um número atômico de 86, então o isótopo pai é representado como {^{222}_{86}Rn}}). Nós representamos a partícula alfa como {^(^{4}_{2}He}) e usamos subtração (222 – 4 = 218 e 86 – 2 = 84) para identificar o isótopo filha como um isótopo de polônio, {^{218}_{84}Po}):
({_{86}^{222}{222}Rnrightarrow, _2^4He + {84}^, _{218}Po})
Exercicio {\i}(PageIndex{1}}Po): Polónio-209
Escreva a equação nuclear que representa o decaimento radioactivo do polónio-209 por emissão de partículas alfa e identifique o isótopo filha.
Resposta
(\ce{_{84}^{209}Po{209}Po}rightarrow \, _2^4He + \, _{82}^{205}Pb})
O segundo maior tipo de emissão radioativa é chamado de partícula beta, simbolizada pela letra grega β. Uma partícula beta é um elétron ejetado do núcleo (não das conchas dos elétrons sobre o núcleo) e tem uma carga 1-. Também podemos representar uma partícula beta como {^0_{-1}e} ou β-. O efeito líquido da emissão de partículas beta sobre um núcleo é que um nêutron é convertido em um próton. O número total de massa permanece o mesmo, mas como o número de prótons aumenta em um, o número atômico sobe em um. O carbono-14 decai ao emitir uma partícula beta:
\
Again, a soma dos números atómicos é a mesma em ambos os lados da equação, tal como a soma dos números de massa. (Note que ao electrão é atribuído um “número atómico” de 1-, igual à sua carga)
O terceiro tipo principal de emissão radioactiva não é uma partícula mas sim uma forma muito energética de radiação electromagnética chamada raios gama, simbolizada pela letra grega γ. Os próprios raios gama não transportam uma carga eléctrica global, mas podem fazer com que os electrões saiam dos átomos de uma amostra de matéria e a tornem carregada electricamente (para a qual os raios gama são designados por radiação ionizante). Por exemplo, no decaimento radioativo do radônio-222, tanto a radiação alfa quanto a gama são emitidas, com esta última tendo uma energia de 8,2 × 10-14 J por núcleo decomposta:
Esta pode não parecer muita energia, mas se 1 mol de átomos de radônio se decompusesse, a energia dos raios gama seria de 49 milhões kJ!
Exemplo \(\PageIndex{2}}): Boron-12
Escreva a equação nuclear que representa o decaimento radioativo do boro-12 por emissão de partículas beta e identifique o isótopo filha. Um raio gama é emitido simultaneamente com a partícula beta.
Solução
O isótopo pai é {^{12}_{5}B}} enquanto um dos produtos é um electrão, {^{0}_{-1}e}). Para que a massa e os números atómicos tenham o mesmo valor em ambos os lados, o número de massa do isótopo filha deve ser 12, e o seu número atómico deve ser 6. O elemento com um número atómico de 6 é o carbono. Assim, a equação nuclear completa é a seguinte:
O isótopo filha é \(\ce{^{12}_6 C}\).
Exercicio \(\PageIndex{2}}): Iodo-131
Escreva a equação nuclear que representa o decaimento radioactivo do iodo131 por emissão de partículas beta e identifique o isótopo filha. Um raio gama é emitido simultaneamente com a partícula beta.
Resposta
Alpha, beta e emissões gama têm diferentes capacidades de penetração de matéria. A partícula alfa relativamente grande é facilmente parada pela matéria (embora possa transmitir uma quantidade significativa de energia para a matéria que contacta). As partículas beta penetram ligeiramente na matéria, talvez alguns centímetros no máximo. Os raios gama podem penetrar profundamente na matéria e podem transmitir uma grande quantidade de energia para a matéria circundante. A tabela {1}PageIndex{2} resume as propriedades dos três principais tipos de emissões radioativas.
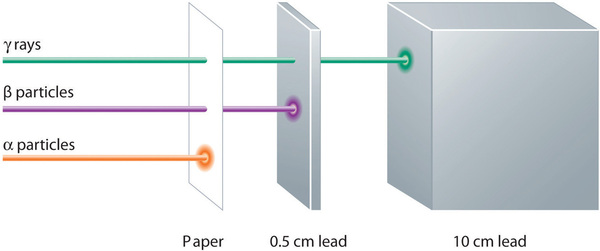
| Características | Partículas Alfa | Partículas Beta | Raios Gama |
|---|---|---|---|
| símbolos | α, \(\mathrm{_{2}^{4}He}\) | β, ({\i1}ce{\i}_{\i1}-1} e}) | γ |
| identidade | núcleo do hélio | electron | eletromagnético radiação |
| carga | 2+ | 1- | nenhuma |
| número de massa | 4 | 0 | 0 |
| potência penetrante | minimal (não penetrará na pele) | curto (penetrará na pele e em alguns tecidos ligeiramente) | profundo (penetrará nos tecidos profundamente) |
Ocasionalmente, um núcleo atômico se rompe em pedaços menores em um processo radioativo chamado fissão espontânea (ou fissão). Tipicamente, os isótopos filhos produzidos pela fissão são uma mistura variada de produtos, em vez de um isótopo específico como no caso da emissão de partículas alfa e beta. Muitas vezes, a fissão produz excesso de neutrões que por vezes serão capturados por outros núcleos, possivelmente induzindo eventos radioactivos adicionais. O urânio-235 sofre uma fissão espontânea em pequena escala. Uma reação típica é
onde {_0^1n}}}é um nêutron. Como em qualquer processo nuclear, as somas dos números atômicos e os números de massa devem ser os mesmos em ambos os lados da equação. A fissão espontânea é encontrada apenas em grandes núcleos. O menor núcleo que exibe fissão espontânea é chumbo-208,
Fissão é o processo radioativo usado em usinas nucleares e um tipo de bomba nuclear.
Key Takeaway
Os principais tipos de radioatividade incluem partículas alfa, partículas beta e raios gama.
Exercício de Revisão de Conceito
-
Quais são os principais tipos de radioatividade? Escreva equações químicas demonstrando cada tipo.
Resposta
-
Os principais tipos de radioatividade são decaimento alfa, decaimento beta e emissão de raios gama; decaimento alfa com emissão de raios gama: \(Mathrm{_{86}^{222}Rn {84}^{218}Po +, ^4_2He + ^gamma}}; decaimento beta: \(respostas irão variar)