- trans-Cinamaldehído Propiedades químicas, usos, producción
- Presentación
- Farmacocinética
- Aplicaciones
- Toxicidad
- Propiedades químicas
- Propiedades químicas
- Propiedades químicas
- Definición
- Referencia(s)
- Descripción general
- Aire &Reacciones en el agua
- Perfil de reactividad
- Peligro de incendio
- Exposición potencial
- Envío
- Incompatibilidades
- Eliminación de residuos
trans-Cinamaldehído Propiedades químicas, usos, producción
Presentación
El cinamaldehído, un antiguo aromatizante derivado de los árboles de canela y otras especies del género Cinnamomum, ha despertado un creciente interés por su capacidad de prevenir el desarrollo de la diabetes y sus complicaciones. Como líquido amarillo y viscoso, el cinamaldehído constituye el 98% del aceite esencial de la corteza de la canela, y fue aislado por primera vez por Dumas y Péligot y luego sintetizado en el laboratorio por el químico italiano Luigi Chiozza (1828-1889) en 1854. En 2007, Subash et al. informaron por primera vez del efecto hipoglucémico e hipolipidémico del cinamaldehído en ratas diabéticas macho Wistar inducidas por estreptozotocina (STZ). Desde entonces, el cinamaldehído se ha estudiado ampliamente en modelos animales de diabetes y obesidad.
La casia o canela china es una especia muy utilizada que se extrae de la corteza interna del árbol de la canela. La casia se ha utilizado durante miles de años con fines medicinales y se considera una de las 50 hierbas fundamentales de la medicina tradicional china. Varias partes de la planta de cassia se utilizan con fines medicinales, como la raíz, la corteza, las hojas y las flores. Se ha informado de que los extractos de canela tienen diversos efectos beneficiosos, como efectos antialérgicos, antimicrobianos, antivirales, antioxidantes, gastroprotectores, antiangiogénicos y anti-Alzheimer, así como actividades biológicas similares a la insulina. Los extractos de canela contienen varios compuestos activos, entre ellos aceites esenciales (cinamaldehído y cinamaldehído), taninos, mucosidad y carbohidratos. Curiosamente, el cinamaldehído, también conocido como aldehído cinámico, muestra efectos antiobesidad al reducir la acumulación de lípidos y regular a la baja el receptor activado por el proliferador de peroxisomas-γ, la proteína de unión al potenciador CCAAT α y la proteína de unión al elemento regulador del esterol 1. Además, el cinamaldehído inhibe la activación microglial inducida por el lipopolisacárido al dirigirse a la proteína relacionada con el receptor de lipoproteínas de baja densidad-1. También se informó de que el cinamaldehído tiene efectos antimutagénicos en las células cancerosas.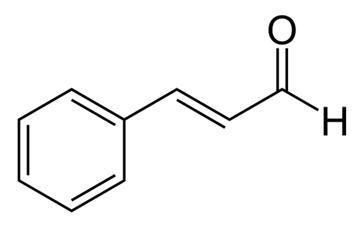
Figura 1 la estructura química del cinamaldehído;
Farmacocinética
El cinamaldehído existe naturalmente en forma de trans-cinamaldehído. En un experimento realizado por Zhao et al. se evalúa la farmacocinética del cinamaldehído en ratas utilizando el enfoque relativamente sensible de la cromatografía de gases-espectrometría de masas (GC-MS) mediante la administración oral (500 mg/kg) y la inyección intravenosa (i.v.,20 mg/kg). Los resultados revelan que el AUC0-t del cinamaldehído por vía oral y por vía i.v. es de 1984 ± 531 y 355 ± 53 ng h/ml, respectivamente. El T1/2 y el Tmáx del cinamaldehído son más largos para la administración oral (6,7 ± 1,5 h y 1,6 ± 0,5 h) que para la administración i.v. (1,7 ± 0,3 h y 0,033 h). La Cmáx es de 249±36 ng/ml para la administración oral y de 547±142 ng/ml para la administración i.v., respectivamente. Los resultados indican que la biodisponibilidad de cinamaldehído mejora más con la administración i.v. que con la oral.
Además, los autores demuestran que la Cmáx y el AUC0-t son proporcionales a la dosis (de 125 a 500 mg), mientras que la Tmáx y el tiempo medio de permanencia no cambian en respuesta al aumento de la dosis. Dado que el cinamaldehído y el alcohol cinamílico pueden transformarse el uno en el otro en las ratas, los autores también analizan la propiedad farmacocinética del alcohol cinamílico en el plasma de las ratas. Los datos farmacocinéticos del alcohol de canela son 1105±337 ng-h/ml para el AUC0-t, 6,7±2,8 h para el T1/2, 1,5±0,7 h para el Tmáx, y 221±66 ng/ml para el Cmáx, a una dosis oral de 500 mg/kg. Curiosamente, el cinamato de metilo también se ha descubierto en los metabolitos. Para conocer las propiedades farmacocinéticas del cinamato de metilo, se recomienda a los lectores interesados que consulten el artículo de Zhao et al. En resumen, el cinamaldehído se distribuye bien por todo el cuerpo tras su absorción. El cinamaldehído puede transformarse en alcohol cinamílico y también puede oxidarse a ácido cinámico después de entrar en el cuerpo. Para comprender plenamente las propiedades farmacocinéticas del cinamaldehído, también hay que determinar el cinamato de metilo y el alcohol cinámico en el plasma. Sin embargo, la inestabilidad del cinamaldehído pone en duda que la bioactividad del cinamaldehído se deba probablemente a la suma de sus metabolitos. Por lo tanto, se espera que se realicen nuevos intentos para abordar las posibles preocupaciones. Además, el recién desarrollado SME-cinamaldehído con una biodisponibilidad mejorada también necesita una mayor investigación del efecto antidiabético.
Aplicaciones
Los extractos de canela tienen varios efectos beneficiosos, entre los que se incluyen efectos antialérgicos, antimicrobianos, antivirales, antioxidantes, gastroprotectores, antiangiogénicos y anti-Alzheimer, así como actividades biológicas similares a la insulina. El cinamaldehído muestra efectos antiobesidad al reducir la acumulación de lípidos y regular a la baja el receptor activado por el proliferador de peroxisomas-γ, la proteína de unión al potenciador CCAAT α y la proteína de unión al elemento regulador del esterol 1. Además, el cinamaldehído inhibe la activación microglial inducida por el lipopolisacárido al dirigirse a la proteína relacionada con el receptor de lipoproteínas de baja densidad-1. También se informó de que el cinamaldehído tiene efectos antimutagénicos en las células cancerosas. A continuación se destaca el efecto del cinamaldehído en el tratamiento del cáncer y la diabetes:
Cáncer
Kwon et al. informaron por primera vez de que los extractos de canela inducen la muerte de células de melanoma in vitro e in vivo mediante la inhibición de NF-κB y AP-1. Un estudio posterior demostró que el HCA es el principal compuesto antitumorigénico encontrado en los extractos de canela, ejerciendo sus efectos inhibidores del crecimiento en 29 tipos de células cancerosas humanas in vitro y en xenoinjertos de tumores humanos SW620 in vivo.
Otros equipos de investigación también han informado de los efectos antitumorigénicos de los extractos de canela. Inhiben las células cancerosas del melanoma al inducir la expresión de factores proangiogénicos; también mejoraron las actividades antitumorigénicas de las células T CD8 al aumentar su actividad citolítica. Los extractos de canela también inhiben el factor de crecimiento endotelial vascular, lo que se descubrió mediante el cribado de compuestos por su actividad inhibidora contra el VEGFR2. La mayor parte de los efectos antitumorigénicos de los extractos de canela pueden atribuirse a los cinamaldehídos, el principal componente del aceite esencial, responsable del sabor y el aroma de la canela entera. Se informó de que los cinamaldehídos inhibían la proliferación de las células cancerosas mediante la inhibición de la ciclina D1 en varios tipos de tumores. Los cinamaldehídos también inducen la apoptosis mediante la generación de especies reactivas de oxígeno en las células de leucemia HL-60 y a través de la activación de las proteínas proapoptóticas de la familia Bcl-2 y la vía de señalización MAPK en las células de hepatoma humano. Además, los cinamaldehídos diméricos derivados del HCA mostraron mayores efectos antitumorigénicos que los monoméricos al inducir la apoptosis y la detención del ciclo celular. Además, varios estudios han revelado que los efectos antitumorigénicos del HCA y sus derivados están mediados por varios mecanismos moleculares. Un estudio reciente demostró que los polifenoles con un andamiaje de cinamaldehído desencadenaban la detención del ciclo celular en la fase G2/M y la muerte celular apoptótica en células humanas de cáncer de ovario resistentes al cisplatino, lo que sugiere que los compuestos de cinamaldehído podrían ser eficaces en las quimioterapias combinadas para pacientes con cáncer. En general, los mecanismos moleculares subyacentes a los efectos anticancerígenos y antimetastásicos de los cinamaldehídos son diversos, lo que sugiere que el cinamaldehído es un compuesto multiobjetivo. Debe evaluarse la capacidad de respuesta diferencial de varios tipos de cáncer a los distintos derivados de la cinamaldehído para poder seleccionar el compuesto más eficaz para cada tipo de cáncer.
Antidiabetes
En las últimas décadas se han realizado estudios para evaluar su papel beneficioso en el control de la diabetes y sus complicaciones. Se ha demostrado que la administración oral de cinamaldehído desde 20 mg/kg de peso corporal hasta 40 mg/kg de peso corporal al día durante una duración de 21 a 60 días dio lugar a una mejora significativa de los niveles de glucosa en sangre y hemoglobina glucosilada, así como de la sensibilidad a la insulina en ratas diabéticas inducidas por STZ. Y se supone que 20 mg/kg-BW es la dosis efectiva para prevenir el desarrollo de la diabetes en los animales. Además, el tratamiento con cinamaldehído durante 4 semanas aumenta los niveles de insulina en el plasma y el contenido de glucógeno en el hígado, así como disminuye los niveles de triglicéridos y de lipoproteínas de baja densidad-colesterol en ratas Wistar macho inducidas por STZ y/o HFD. Además, Camacho et al. descubrieron que la administración de cinamaldehído durante 5 semanas a ratones C57BL/6J alimentados con HFD conducía significativamente a una reducción de la ganancia de masa grasa corporal. Sin embargo, afirmaron que el tratamiento con cinamaldehído no alteraba los niveles plasmáticos de insulina en ayunas ni el consumo de alimento. La razón de la incoherencia respecto a la regulación de la insulina podría atribuirse a que los antecedentes genéticos de los ratones C57BL/6J están alterados en algunas instalaciones de producción. Las distintas subrazas de ratones pueden presentar diferencias significativas en sus fenotipos. Además, en el estudio de Camacho, el cinamaldehído puede mostrar un efecto reductor de la glucosa a través de la mejora de la sensibilidad a la insulina en la periferia.
El cinamaldehído tiene la capacidad de mejorar los tejidos adiposos de los diabéticos reduciendo la deposición de grasa visceral, y promoviendo la lipólisis y la oxidación de ácidos grasos y la termogénesis, lo que se asocia con una regulación al alza de los genes del gasto energético, una inhibición de PPARγ/CEBP-α y SREBP1, un aumento de HSL y PNPLA2 y MGL, una inducción de la fosforilación de AMPK, y un aumento de Cpt1a en WAT y Acsl4 en BAT, así como una estimulación del sistema nervioso simpático. Además, el cinamaldehído previene la expresión de genes inflamatorios y mejora la expresión de GLUTs en los animales diabéticos. El cinamaldehído puede proteger contra la diabetes mejorando la sensibilidad a la insulina y la captación de glucosa a través de la regulación de la vía PI3K/IRS-1 y RBP4-GLUT4 en el tejido muscular esquelético, así como regulando el metabolismo de las mitocondrias a través de la vía PGC-1α/MEF2/GLUT4 en las células C2C12. El cinamaldehído también tiene efectos positivos en el hígado diabético a través de la mejora de las síntesis de glucógeno mediante la regulación de las actividades de PK y PEPCK y la disminución del nivel de RBP4, así como la normalización de las enzimas hepáticas aberrantes, lo que sugiere un papel beneficioso de este compuesto en el metabolismo de la glucosa y la sensibilidad a la insulina en el hígado diabético.
Efectos antimicrobianos
Un estudio ha confirmado la actividad antimicrobiana del cinamaldehído, el clavo, el tomillo y el romero contra la E. coli O157:H7 y la Salmonella. Wendakoon y Sakaguchi informaron de que el grupo carbonilo del cinamaldehído se une a las proteínas, impidiendo la actividad de la descarboxilasa de aminoácidos en Enterobacter aerogenes. Smid et al. observaron que la membrana citoplasmática de Saccharomyces cerevisiae se dañaba cuando se trataba con cinamaldehído, lo que provocaba una fuga excesiva de metabolitos y enzimas de la célula y, finalmente, la pérdida de viabilidad. La mayoría de los estudios han sugerido que los modos de acción de los aceites esenciales dependen del tipo de microorganismos, principalmente de la estructura de su pared celular y de la disposición de su membrana externa. Observaron daños debidos a las diferencias significativas en las membranas externas de las bacterias gramnegativas y grampositivas.
Toxicidad
Incluso ahora, se sigue asumiendo que el cinamaldehído es un agente natural seguro y bien tolerado en humanos y animales. El concepto también está bien aceptado por la FDA y el Consejo de Europa con la sugerencia de una ingesta diaria aceptable de 1,25 mg/kg.
Toxicidad aguda
Se ha informado de que el cinamaldehído tiene un alto margen de seguridad, y que la administración de 20 veces la dosis efectiva (20 mg/kg) de este compuesto no causó signos anormales de comportamiento ni alteró los valores de la química sérica a lo largo del estudio. La toxicidad aguda del cinamaldehído es baja, con valores de dosis letal media oral (DL50) que oscilan entre un mínimo de 0,6 g/kg de peso corporal y un máximo de 3,4 g/kg de peso corporal en diferentes especies.
Toxicidad a largo plazo
Los resultados de un estudio de tres meses muestran que el peso corporal se reduce en las ratas hembras expuestas a 16.500 o 33.000 ppm y en los ratones hembra expuestos a 8200 ppm o más. Además, el consumo de alimento se reduce en todos los grupos de ratas expuestas y en el grupo de ratones con la dosis más alta. Además, la exposición al cinamaldehído aumenta la incidencia de la hiperplasia epitelial escamosa del estómago. Además, los ratones expuestos al cinamaldehído también muestran una mayor incidencia de degeneración epitelial olfativa de la cavidad nasal. Todas las ratas sobrevivieron a lo largo del estudio de tres meses.
Otros
El cinamaldehído también puede mostrar efectos citotóxicos en los hepatocitos de rata F344, evidenciados por el agotamiento de los niveles de glutatión, y en las células HepG2, evidenciados por el aumento del número de micronúcleos. Behar et al. estudiaron la toxicidad potencial de este producto en células embrionarias y pulmonares humanas. Los resultados demuestran que el tratamiento con cinamaldehído despolimeriza los microtúbulos en los fibroblastos pulmonares humanos. El cinamaldehído también disminuye la proliferación y la diferenciación celular al inhibir el crecimiento y la diferenciación celular, y al alterar la morfología y la motilidad de las células, así como al aumentar las roturas de la cadena de ADN y la muerte celular. Un estudio realizado por Olsen et al. revela que el cinamaldehído causa irritación en la piel al aumentar el umbral de dolor por frío y disminuir el umbral de dolor mecánico, así como al aumentar la temperatura y la perfusión de la piel en humanos.
- Zhou M, Chen Z, Shen S. Recent advanceson cinnamaldehyde. Journal of Economic Animal 2015;19:1-5.
- Khare P, Jagtap S, Jain Y, Baboota RK, Mangal P, Boparai RK, Bhutani KK, Sharma SS, Premkumar LS, Kondepudi KK, Chopra K, Bishnoi M. La suplementación con cinamaldehído previene la hiperfagia inducida por el ayuno, la acumulación de lípidos y la inflamación en ratones alimentados con una dieta alta en grasas. BioFactors 2016;42:201-211.
- Ma R, Zhu R, Wang L, Guo Y, Liu C, Liu H, Liu F, Li H, Li Y, Fu M, Zhang D. Osteoporosis diabética: A review of its traditional chinese medicinal use and clinical and preclinical research. Medicina complementaria y alternativa basada en la evidencia : eCAM 2016;2016:3218313.
- Dumas JP, E. Investigación en química orgánica – sobre el aceite de canela, el ácido hipúrico y el ácido sebácico. Annales de chimie et de physique 1834;57:305-334.
- Chiozza L. Sur la production artificielle de l’essence de cannelle». Comptes rendus 1856;42:222-227.
- Subash Babu P, Prabuseenivasan S, Ignacimuthu S. Cinnamaldehyde–a potential antidiabetic agent. Phytomedicine : international journal of phytotherapy and phytopharmacology 2007;14:15-22.
- Hagenlocher Y, Bergheim I, Zacheja S, Schaffer M, Bischoff SC, Lorentz A. 2013. El extracto de canela inhibe la degranulación y la síntesis de novo de mediadores inflamatorios en los mastocitos. Allergy 68: 490-497.
- Matan N, Rimkeeree H, Mawson AJ, Chompreeda P, Haruthaithanasan V, Parker M. 2006. Actividad antimicrobiana de los aceites de canela y clavo en condiciones de atmósfera modificada. Int J Food Microbiol 107: 180-185.
- Fink RC, Roschek B Jr, Alberte RS. 2009. Inhibidores de la entrada del VIH tipo 1 con un nuevo modo de acción. Antivir Chem Chemother 19: 243-255.
- Yang CH, Li RX, Chuang LY. 2012. Antioxidant activity of various parts of Cinnamomum cassia extracted with different extraction methods. Molecules 17: 7294-7304.
- Peterson DW et al. 2009. El extracto de canela inhibe la agregación de tau asociada a la enfermedad de Alzheimer in vitro. J Alzheimers Dis 17: 585-597.
- Cheng DM, Kuhn P, Poulev A, Rojo LE, Lila MA, Raskin I. 2012. Efectos antidiabéticos in vivo e in vitro del extracto acuoso de canela y de la matriz alimentaria mejorada con polifenoles de canela. Food Chem 135: 2994-3002.
- Kim JE et al. 2015a. Un nuevo producto natural relacionado con la canela con actividad inhibidora de Pim-1 inhibe la leucemia y el cáncer de piel. Cancer Res 75: 2716-2728.
- Hwang H et al. 2011. El 2′-Hidroxicinamaldehído se dirige a la proteína-1 relacionada con el receptor de lipoproteínas de baja densidad para inhibir la activación microglial inducida por el lipopolisacárido. J Neuroimmunol2011 230: 52-56.
- Shaughnessy DT, Setzer RW, DeMarini DM. 2001. El efecto antimutagénico de la vainillina y el cinamaldehído sobre la mutación espontánea en Salmonella TA104 se debe a una reducción de las mutaciones en sitios GC pero no AT. Mutat Res 480: 55-69.
- Zhang LQ, Zhang ZG, Fu Y, Xu Y. Progreso en la investigación de los efectos farmacológicos del trans-cinamaldehído. Zhongguo Zhong yao za zhi = Zhongguo zhongyao zazhi = China journal of Chinese materia medica 2015;40:4568-4572.
- Zhao H, Xie Y, Yang Q, Cao Y, Tu H, Cao W, Wang S. Pharmacokinetic study of cinnamaldehyde in rats by gc-ms after oral and intravenous administration. Journal of pharmaceutical and biomedical analysis 2014;89:150-157.
- Kwon BM et al. 1998. Síntesis y citotoxicidad in vitro de los cinamaldehídos para las células tumorales sólidas humanas. Arch Pharm Res 21: 147-152.
- Lee CW et al. 1999. Inhibición del crecimiento de tumores humanos por 2′-hidroxi y 2′-benzoiloxicinamaldehídos. Planta Med 65: 263-266
- Kwon HK et al. 2009. Cinnamon extract suppresses tumor progression by modulating angiogenesis and the effector function of CD8+ T cells. Cancer Lett 278: 174-182.
- Lu J, Zhang K, Nam S, Anderson RA, Jove R,WenW. 2010. La nueva actividad inhibidora de la angiogénesis en el extracto de canela bloquea la quinasa VEGFR2 y la señalización descendente. Carcinogenesis 31: 481-488.
- Jeong HW et al. 2000. Cinnamaldehydes inhibe la quinasa dependiente de ciclina 4/ciclina D1. Bioorg Med Chem Lett 10: 1819-1822.
- Ka H et al. 2003. Cinnamaldehyde induce la apoptosis por transición de permeabilidad mitocondrial mediada por ROS en células de leucemia promielocítica humana HL-60. Cancer Lett 196: 143-152.
- Wu SJ, Ng LT, Lin CC. 2005. Cinnamaldehyde-induced apoptosis in human PLC/PRF/5 cells through activation of the proapoptotic Bcl-2 family proteins and MAPK pathway. Life Sci 77: 938-951.
- Shin DS et al. 2006. Synthesis and biological evaluation of dimeric cinnamaldehydes as potent antitumor agents. Bioorg Med Chem 14: 2498-2506.
- Shin SY et al. 2014. Polyphenols bearing cinnamaldehyde scaffold showing cell growth inhibitory effects on the cisplatinresistant A2780/Cis ovarian cancer cells. Bioorg Med Chem 22: 1809-1820.
- Lee SC, Xu WX, Lin LY, Yang JJ, Liu CT. Composición química y efecto hipoglucémico y protector del páncreas del aceite esencial de hoja de canela indígena. Journal of agricultural and food chemistry 2013;61:4905-4913.
- El-Bassossy HM, Fahmy A, Badawy D. Cinnamaldehyde protects from the hypertension associated with diabetes. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association 2011;49:3007-3012.
- Li M, Xu Y, Zhang W. Effects of cinnamaldehyde on the expression levels of irs-1 and p85 alpha in gastrocnemius of type 2 diabetic rats. Medical Journal of Wuhan University 2009;30:723-726=731.
- Kumar S, Vasudeva N, Sharma S. Gc-ms analysis and screening of antidiabetic, antioxidant and hypolipidemic potential of cinnamomum tamala oil in streptozotocin induced diabetes mellitus in rats. Cardiovascular diabetology 2012;11:95.
- Camacho S, Michlig S, de Senarclens-Bezencon C, Meylan J, Meystre J, Pezzoli M, Markram H, le Coutre J. Efectos antiobesidad y antihiperglucémicos del cinnamaldehído a través de la alteración de la secreción de grelina y el impacto funcional en la ingesta de alimentos y el vaciado gástrico. Informes científicos 2015;5:7919.
- Navarro SJ, Trinh T, Lucas CA, Ross AJ, Waymire KG, Macgregor GR. El fondo de la cepa de ratón c57bl/6j modifica el efecto de una mutación en bcl2l2. G3 2012;2:99-102.
- Mekada K, Abe K, Murakami A, Nakamura S, Nakata H, Moriwaki K, Obata Y, Yoshiki A. Genetic differences among c57bl/6 substrains. Experimental animals 2009;58:141-149.
- Kiselycznyk C, Holmes A. All mice are not created equal. Frontiers in neuroscience 2011;5:10.
- Attane C, Peyot ML, Lussier R, Zhang D, Joly E, Madiraju SR, Prentki M. Differential insulin secretion of high-fat diet-fed c57bl/6nn and c57bl/6nj mice: Implicaciones del fondo genético mixto en los estudios metabólicos. PloS one 2016;11:e0159165.
- Nicholas P G, Schnuckc. JK, Mermierd. CM, Conne. CA, Vaughanc. RA. El trans-cinamaldehído estimula la biogénesis mitocondrial a través de pgc-1α y pparβ/δ conduciendo a una mayor expresión de glut4. Biochimie 2015;119:45-51.
- Zhang W, Xu YC, Guo FJ, Meng Y, Li ML. Efectos antidiabéticos de cinamaldehído y berberina y sus impactos en la expresión de la proteína de unión al retinol 4 en ratas con diabetes mellitus tipo 2. Chin Med J 2008;121:2124-2128.
- Bandyopadhyay GK, Yu JG, Ofrecio J, Olefsky JM. Aumento de la expresión de p85/55/50 y disminución de la actividad fosfotidilinositol 3-cinasa en el músculo esquelético humano resistente a la insulina. Diabetes 2005;54:2351-2359.
- Saraswathi V, Ramnanan CJ, Wilks AW, Desouza CV, Eller AA, Murali G, Ramalingam R, Milne GL, Coate KC, Edgerton DS. Impacto de la deficiencia de ciclooxigenasa-1 hematopoyética en la inflamación del tejido adiposo vinculada a la obesidad y en los trastornos metabólicos en ratones. Metabolism: clinical and experimental 2013;62:1673-1685.
- Ohaeri OC. Efecto del aceite de ajo en los niveles de varias enzimas en el suero y el tejido de ratas diabéticas con estreptozotocina. Bioscience reports 2001;21:19-24.
- Mahfouz MH, Assiri AM, Mukhtar MH. Evaluación de la lipocalina asociada a la gelatinasa de neutrófilos (ngal] y la proteína de unión al retinol 4 en pacientes diabéticos tipo 2 con nefropatía. Biomarker insights 2016;11:31-40.
- SHAN, B., CAY, Y.-Z., BROOKS, J.D. and CORKE, H. 2007. Propiedades antibacterianas y principales componentes bioactivos de la canela en rama: Activity against foodborne pathogenic bacteria. J. Agric. Food Chem. 55, 5484-5490
- RHAYOUR, K., BOUCHIKHI, T., TANTAOUI-ELARAKI, A., SENDIDE, K. y REMMAL, A. 2003. The mechanism of bactericidal action of oregano and clove essential oils of their phenolic major components on Escherichia coli and Bacillus subtilis. J. Essent. Oil Res. 15, 356-362.
- KIM, H.-O., PARK, S.-W. and PARK, H.-D. 2004. Inactivation of Escherichia coli O157:H7 by cinnamic aldehyde purified from Cinnamomum cassia shoot. Food Microbiol. 21, 105-110
- WENDAKOON, C. y SAKAGUCHI, M. 1995. Inhibition of amino acid decarboxylase activity of Enterobacter aerogenes by active components in spices. J. Food Prot. 58, 280-283.
- SMID, E.J., KOEKEN, J.P.G. y GORRIS, L.G.M. 1996. Acción fungicida y fungistática de los metabolitos secundarios de las plantas cinamaldehído y carvona. En Modern Fungicides and Antimicrobial Compounds pp. 173-180, Intercept, Andover, U.K.
- Dugoua JJ, Seely D, Perri D, Cooley K, Forelli T, Mills E, Koren G. From type 2 diabetes to antioxidant activity: Una revisión sistemática de la seguridad y eficacia de la corteza de canela común y cassia. Canadian journal of physiology and pharmacology 2007;85:837-847.
- Anand P, Murali KY, Tandon V, Murthy PS, Chandra R. Insulinotropic effect of cinnamaldehyde on transcriptional regulation of pyruvate kinase, phosphoenolpyruvate carboxykinase, and glut4 translocation in experimental diabetic rats. Chemico-biological interactions 2010;186:72-81.
- Gowder SJT. Evaluación de la seguridad del sabor de los alimentos -cinamaldehído. Biosafety 2014;3
- Hooth MJ, Sills RC, Burka LT, Haseman JK, Witt KL, Orzech DP, Fuciarelli AF, Graves SW, Johnson JD, Bucher JR. Toxicología y estudios de carcinogénesis de trans-cinamaldehído microencapsulado en ratas y ratones. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association 2004;42:1757-1768.
- Swales NJ, Caldwell J. Studies on trans-cinnamaldehyde ii: Mechanisms of cytotoxicity in rat isolated hepatocytes. Toxicology in vitro : an international journal published in association with BIBRA 1996;10:37-42.
- Sanyal R, Darroudi F, Parzefall W, Nagao M, Knasmuller S. Inhibition of the genotoxic effects of heterocyclic amines in human derived hepatoma cells by dietary bioantimutagens. Mutagenesis 1997;12:297-303.
- Behar RZ, Luo W, Lin SC, Wang Y, Valle J, Pankow JF, Talbot P. Distribución, cuantificación y toxicidad del cinamaldehído en los fluidos de recarga y aerosoles de los cigarrillos electrónicos. Tobacco control 2016
- Olsen RV, Andersen HH, Moller HG, Eskelund PW, Arendt-Nielsen L. Manifestaciones somatosensoriales y vasomotoras de la estimulación individual y combinada de trpm8 y trpa1 usando l-mentol tópico y trans-cinamaldehído en voluntarios sanos. European journal of pain 2014;18:1333-1342.
Propiedades químicas
El trans-cinamaldehído es el componente principal del aceite de casia (alrededor del 90%) y del aceite de corteza de canela de Sri Lanka (alrededor del 75%). En muchos otros aceites esenciales se encuentran cantidades más pequeñas. En la naturaleza, predomina el isómero trans.
El trans-Cinamaldehído es un líquido amarillento con un olor picante característico, que recuerda mucho a la canela. Al ser un aldehído insaturado, sufre muchas reacciones, de las cuales la hidrogenación a alcohol cinámico, dihidrocinamaldehído y alcohol dihidrocinámico es importante. El ácido cinámico se forma por autoxidación.
A escala industrial, el cinamaldehído se prepara casi exclusivamente por condensación alcalina de benzaldehído y acetaldehído. La autocondensación de acetaldehído puede evitarse utilizando un exceso de benzaldehído y añadiendo lentamente acetaldehído.
El cinamaldehído se utiliza en muchas composiciones para crear notas especiadas y orientales (por ejemplo, perfumes de jabón). Es el principal componente del aceite de canela artificial. Además, es un intermedio importante en la síntesis del alcohol cinámico y del alcohol dihidrocinámico.
Propiedades químicas
Líquido amarillo claro
Propiedades químicas
Líquido combustible, amarillento y aceitoso (se espesa con la exposición al aire). Olor fuerte, picante, a canela.
Definición
ChEBI: El estereoisómero E (trans) del cinamaldehído, el padre de la clase de los cinamaldehídos.
Referencia(s)
Chemistry Letters, 12, p. 1207, 1983
Journal of the American Chemical Society, 93, p. 2080, 1971 DOI: 10.1021/ja00737a057
Tetrahedron Letters, 18, p. 1215, 1977
Descripción general
Líquido amarillo claro con olor a canela y sabor dulce.
Aire &Reacciones en el agua
Puede ser sensible a la exposición prolongada al aire y a la luz. Insoluble en agua.
Perfil de reactividad
El trans-Cinamaldehído es incompatible con agentes oxidantes fuertes y bases fuertes. El trans-Cinamaldehído también puede reaccionar con el hidróxido de sodio.
Peligro de incendio
El trans-Cinamaldehído es combustible.
Exposición potencial
Fungicida e insecticida botánico. Se utiliza como agente antifúngico, atrayente del gusano de la raíz del maíz y repelente de perros y gatos. Se puede utilizar en la cubierta del suelo para los hongos, los cultivos en hilera, el césped y todos los productos alimenticios. No está catalogado para su uso en los países de la UE.
Envío
UN1989 Aldehídos, n.e.p., Clase de peligro: 3; Etiquetas: 3-Líquido inflamable
Incompatibilidades
Los aldehídos participan frecuentemente en reacciones de autocondensación o polimerización. Estas reacciones son exotérmicas; a menudo son catalizadas por el ácido. Los aldehídos se oxidan fácilmente para dar ácidos carboxílicos. Se generan gases inflamables y/o tóxicos por la combinación de aldehídos con compuestos azoicos, diazoicos, ditiocarbamatos, nitruros y agentes reductores fuertes. Los aldehídos pueden reaccionar con el aire para dar primero peroxoácidos y, finalmente, ácidos carboxílicos. Estas reacciones de autoxidación son activadas por la luz, catalizadas por sales de metales de transición y son autocatalíticas (catalizadas por los productos de la reacción). La adición de estabilizadores (antioxidantes) a los envíos de aldehídos retrasa la autoxidación. Incompatible con oxidantes (cloratos, nitratos, peróxidos, permanganatos, percloratos, cloro, bromo, flúor, etc.); el contacto puede provocar incendios o explosiones. Mantener alejado de materiales alcalinos, bases fuertes, ácidos fuertes, oxoácidos, epóxidos, cetonas, colorantes azoicos, cáusticos, boranos, hidracinas
Eliminación de residuos
Incineración. De acuerdo con el 40CFR165, siga las recomendaciones para la eliminación de plaguicidas y contenedores de plaguicidas.