Meera Senthilingam
Esta semana, una visión de la vida de un becario de laboratorio de química. Y recordando esto está Brian Clegg:
Brian Clegg
Entre la escuela y la universidad, con un nuevo y brillante nivel de química en mi haber, pasé el verano trabajando en un laboratorio industrial. Como lo más bajo de lo bajo, mis trabajos eran los que nadie más quería hacer. La función de nuestro laboratorio era analizar las materias primas que llegaban a una planta especializada en ácidos grasos. El peor trabajo era, sin duda, el de «parachoques», un apodo de origen incierto para salir a la calle con cualquier tiempo y subirse a los camiones cisterna de productos químicos para tomar muestras del contenido caliente. En el mejor de los casos, esto significaba manipular aceite de nuez de cacao de olor dulce y, en el peor, sebo apestoso. Tras estas excursiones, el equipo de toma de muestras se unía a las interminables pilas de material de laboratorio sucio que también eran mi responsabilidad. Y ahí es donde tuve mi introducción al tetracloruro de carbono.

Fuente: ©
En aquella época, el tetracloruro de carbono era un limpiador de laboratorio casi universal. Lo utilizábamos con desenfreno, aprovechando la capacidad de este disolvente para disolver sustancias difíciles de eliminar, como los aceites y las grasas. Ahora miro hacia atrás con cierto horror: hoy sabemos que el tetracloruro de carbono provoca daños en el sistema nervioso y en los órganos, y que podría ser un carcinógeno.
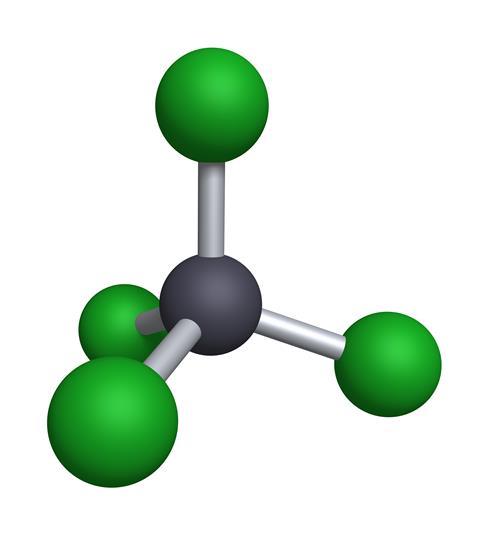
Este simple compuesto de un átomo de carbono con cuatro átomos de cloro unidos es un líquido claro e incoloro a temperatura ambiente y tiene un olor embriagador, casi afrutado. Fue fabricado por primera vez en 1839 por Henry Victor Regnault, probablemente más conocido como físico, pero al principio de su carrera fue un ocupado investigador en química orgánica. Tomó el cloroformo, que es una molécula similar con un átomo de hidrógeno en lugar de uno de cloro, y lo hizo reaccionar con gas de cloro para obtener tetracloruro de carbono. Hoy en día, el punto de partida suele ser metano -CH4- fácilmente disponible y mucho cloro, generalmente producido por electrólisis de agua salada.
A principios del siglo XX, el tetracloruro de carbono encontró multitud de usos. Como disolvente superlativo, era un producto obvio para la limpieza en seco. Este proceso de nombre extraño (sólo es seco en el sentido de que no interviene el agua) se utiliza para limpiar tejidos que se dañarían con el lavado convencional. Los primeros agentes de limpieza en seco, que se remontan a mediados del siglo XIX, eran la gasolina y el queroseno, pero éstos eran vergonzosamente inflamables, por lo que se buscó un disolvente que siguiera haciendo el trabajo pero que no estallara en llamas ni hiciera explotar las máquinas.
Fuente: ©
El tetracloruro de carbono parecía una opción ideal. Se fabricaba de forma fácil y barata y funcionaba bien, pero el descubrimiento de que también era muy tóxico hizo que en la década de 1930 se sustituyera por el tetracloroetileno (conocido en el sector como «perc» por su nombre más antiguo, percloroetileno), que se ha seguido utilizando hasta la actualidad, aunque también se está sustituyendo debido a la preocupación por su potencial cancerígeno.
El tetocarbono (como se le conocía cariñosamente en el laboratorio) también se utilizó en pequeños extintores. Una fina pulverización se vaporizaba con el calor del fuego y lo apagaba suprimiendo las reacciones de combustión.
En el extremo opuesto del espectro de temperaturas, ayudó a muchos de los primeros refrigeradores a hacer su trabajo. Aunque inicialmente se utilizó como refrigerante por derecho propio, su papel principal fue en la producción de gases freón como el diclorodifluorometano. Esta fue la mayor aplicación industrial del tetracloruro de carbono hasta que se descubrió que estos gases de clorofluorocarbono (o CFC) estaban teniendo un grave impacto en la capa de ozono.
Quizás lo más extraño es que también era un favorito de los coleccionistas de sellos. A menudo, la marca de agua en el papel es la única forma de distinguir con seguridad entre las variantes de un sello, por lo que los coleccionistas de sellos siempre han estado interesados en formas de hacerlas más visibles. Hoy en día es probable que utilicen lámparas especializadas, pero unas gotas de tetracloruro de carbono fueron consideradas en su día una excelente manera de revelar la marca de agua sin dañar el papel. Incluso eliminaba las marcas de grasa en el proceso.

Fuente: ©
Para los usuarios de principios del siglo XX, el tetracloruro de carbono parecía una maravilla para todo. Pero las grietas comenzaron a aparecer. Respirar el vapor hacía que los trabajadores se sintieran inicialmente intoxicados, luego con náuseas, mareos y tendencia a los dolores de cabeza. Con el tiempo se descubrió que la exposición al tetracloruro de carbono provocaba daños en el sistema nervioso central, y que dosis elevadas inhibían la función hepática y renal. En el extremo puede matar. También se sospecha que es un carcinógeno, aunque esto no se ha establecido claramente.
Para empeorar las cosas, el tetracloruro de carbono puede convertirse en fosgeno cuando se calienta fuertemente. Este gas, conocido por su olor a heno recién cortado, se utilizó con efectos mortales en la Primera Guerra Mundial. El fosgeno bloquea las proteínas que permiten que el oxígeno sea procesado por los alvéolos de los pulmones, dejando a la víctima sin aire y muriendo. Así que esos extintores de carbono se convirtieron en armas químicas involuntarias. Y para colmo, como cómplice de la destrucción de la capa de ozono, daña nuestro medio ambiente, además de nuestra salud.
Estos problemas han provocado un enorme descenso en el uso del tetracloruro de carbono. Es muy poco probable que se maneje tan casualmente en los laboratorios como antes y, aunque todavía se utiliza para fabricar refrigerantes, es un compuesto muy de ayer. El apogeo del tetracloruro de carbono fue una época diferente. Una época en la que el riesgo estaba muy por detrás de la novedad. Y sin embargo, la simplicidad de su estructura y la exuberancia juvenil de sus usos originales significan que no debe ser olvidado.
Meera Senthilingam
Y gracias a este podcast, no lo será. Ese fue el escritor científico Brian Clegg, llevándonos a una época en la que el tetracloruro de carbono estaba en su apogeo. Ahora, la semana que viene, seguimos mirando al pasado y escarbamos para desvelar el lado más sucio de los inicios de la biotecnología.
Lars ?hrstr?m
Cuando pensamos en biotecnología, pensamos en brillantes reactores de acero inoxidable, en hombres y mujeres con batas blancas de laboratorio, en pipetas, jeringuillas y procesos controlados por ordenador en salas blancas. Normalmente no pensamos en palas, estiércol y calderos oxidados de tamaño humano. Pero así eran los instrumentos y los reactivos de los peteneros, posiblemente los primeros químicos del gobierno. Estas bandas de mala reputación, pero bien organizadas, causaron estragos en las granjas del siglo XVII, desenterrando graneros y establos en una búsqueda sancionada por el Estado de su homónimo, el salitre; también conocido como nitrato de potasio.
Meera Senthilingam
Y para descubrir los usos del nitrato de potasio que hacen que merezca la pena casudiung tal destrucción, únase a Lars ?hrstr?m en la próxima semana de Química en su elemento. Hasta entonces, gracias por escuchar. Soy Meera Senthilingam.