- Activación de células satélite y retención del potencial regenerativo del músculo tras una denervación a largo plazo
- El litio modula los niveles de miR-1906 de las vesículas extracelulares derivadas de células madre mesenquimales contribuyendo a la neuroprotección tras el accidente cerebrovascular mediante la regulación del receptor toll-like 4
- Las vesículas extracelulares derivadas de los fibroblastos promueven la curación de heridas mediante la optimización de las funciones celulares de los fibroblastos y del endotelio
- Coadministración de células endoteliales y de músculo liso derivadas de células madre pluripotentes inducidas humanas como terapia para la isquemia crítica de las extremidades
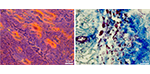
Activación de células satélite y retención del potencial regenerativo del músculo tras una denervación a largo plazo
Alvin Wong, et al., STEM CELLS
La lesión del nervio motor provoca una atrofia del órgano final que es permanente si se retrasa la reinervación. A pesar de la enormidad del problema clínico, la fisiopatología que impide la recuperación muscular es poco conocida. Los autores informan de que, incluso después de períodos prolongados tras una lesión nerviosa, las células madre del músculo denervado mantienen capacidades regenerativas comparables a las del músculo no lesionado. Estos resultados indican que la observación de que la denervación prolongada da lugar a una atrofia muscular permanente no se debe a un cambio intrínseco en el potencial regenerativo de las células madre musculares y sugiere que los esfuerzos para restaurar la función deben centrarse en las señales para inducir la regeneración intrínseca y la restauración de la continuidad neuromuscular.
El litio modula los niveles de miR-1906 de las vesículas extracelulares derivadas de células madre mesenquimales contribuyendo a la neuroprotección tras el accidente cerebrovascular mediante la regulación del receptor toll-like 4

Matteo Haupt, et al, STEM CELLS Translational Medicine
El presente trabajo indica, por primera vez, un mayor potencial terapéutico de las vesículas extracelulares (EVs) derivadas de células madre mesenquimales precondicionadas con litio contra la isquemia cerebral. Al dilucidar una nueva vía de acción de dichas VE enriquecidas, el presente trabajo demuestra un aumento de las concentraciones intravesiculares de miRNAs seleccionados, como miR-1906. Este último regula el receptor Toll-like 4 y las cascadas de señalización proinflamatorias familiares, contribuyendo a una mejor recuperación neurológica tras el accidente cerebrovascular. Por lo tanto, este trabajo proporciona una evidencia adicional y novedosa del potencial terapéutico de las VE contra el ictus, allanando el camino para estudios traslacionales adicionales y ensayos clínicos en entornos de ictus.
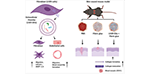
Las vesículas extracelulares derivadas de los fibroblastos promueven la curación de heridas mediante la optimización de las funciones celulares de los fibroblastos y del endotelio
Eun Jung Oh, et al, CÉLULAS MADRE
Las vesículas extracelulares (EVs) se han mostrado como candidatos capaces de entregar cargas terapéuticas endógenas para terapias regenerativas. Los fibroblastos podrían ser células fuente candidatas para las VE, para investigar sus efectos terapéuticos en la curación de heridas. Según el conocimiento de los autores, éste es el primer estudio que investiga los efectos de curación de heridas in vitro de las VE secretadas por fibroblastos derivados de murinos. Este estudio demostró la curación de heridas de espesor total utilizando un modelo de ratón y los efectos de curación de heridas in vivo utilizando una combinación de pegamento de fibrina disponible en el mercado y EVs secretadas por fibroblastos.
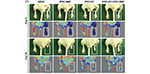
Coadministración de células endoteliales y de músculo liso derivadas de células madre pluripotentes inducidas humanas como terapia para la isquemia crítica de las extremidades
Jin Ju Park, et al, STEM CELLS Translational Medicine
La enfermedad isquémica es una enfermedad arterial periférica, que indica dolor durante el reposo con necrosis y úlceras que conducen a la amputación. Debido a la capacidad de las células endoteliales y las células del músculo liso vascular para regenerar la arteria periférica en los tejidos isquémicos, las terapias basadas en células proporcionan un medio prometedor para tratar a los pacientes con enfermedad isquémica. Este estudio demuestra que el cotransplante de células endoteliales derivadas de células madre pluripotentes inducidas y de células musculares lisas mejora la perfusión sanguínea y la tasa de salvamento de la extremidad mediante la promoción de la neovascularización en la extremidad isquémica a través del mecanismo paracrino mediado por exosomas derivados de células musculares lisas. Este estudio presenta una nueva técnica de terapia celular para el tratamiento de enfermedades vasculares periféricas.