Entre las especies humanas de Neisseria y afines, tres especies -N. mucosa, M. catarrhalis y K. denitrificans reducen el nitrato. La prueba de reducción de nitrato es una prueba crítica para diferenciar entre N. gonorrhoeae y K. denitrificans, especialmente cuando las cepas de K. denitrificans parecen ser diplococos gramnegativos en los frotis teñidos.
Principio
Las especies bacterianas pueden diferenciarse sobre la base de su capacidad para reducir el nitrato a nitrito o gases nitrogenados. Entre las Neisseriaceae de origen humano, las cepas de Neisseria mucosa, Moraxella catarrhalis y Kingella denitrificans reducen el nitrato. Las cepas de M. catarrhalis y K. denitrificans se han identificado erróneamente como N. gonorrhoeae. La prueba de reducción del nitrato permite diferenciar entre estas especies, que son positivas al nitrato, y N. gonorrhoeae (negativa al nitrato). La reducción del nitrato puede ir unida a la respiración anaeróbica en algunas especies.
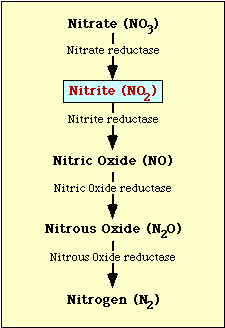
La vía bioquímica implicada en la reducción del nitrato se muestra en la figura 1. El nitrato se reduce a nitrito, que a su vez puede reducirse a óxido nítrico, óxido nitroso o nitrógeno (Figura 1).
Figura l. Vía de reducción del nitrato.
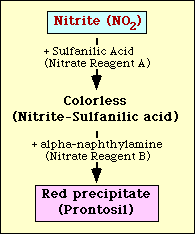
La prueba de reducción del nitrato se basa en la detección de nitrito en el medio tras la incubación con un organismo. Si está presente en el medio, el nitrito reaccionará con el ácido sulfanílico (reactivo A del nitrato) para formar un complejo incoloro (nitrito-ácido sulfanílico). Este complejo dará lugar a un precipitado rojo (prontosil) cuando se añada el reactivo de nitrato B (alfa-naftilamina) a la prueba, como se muestra en la figura 2.
Figura 2. Representación diagramática de la detección de nitritos en el medio.
Sólo se producirá un color rojo en el medio cuando haya nitritos en él. La falta de un color rojo en el medio después de la adición de ácido sulfanílico y alfa-naftilamina significa solamente que el nitrito no está presente en el medio. Puede haber dos explicaciones para esta observación.
- El nitrato puede no haberse reducido; la cepa es nitrato-negativa.
- El nitrato puede haberse reducido a nitrito que luego se ha reducido completamente a óxido nítrico, óxido nitroso o nitrógeno que no reaccionará con los reactivos que reaccionan con el nitrito; la cepa es nitrato-positiva.
Cualquier medio de prueba que dé un resultado negativo después de la adición de los reactivos de nitrato debe someterse a más pruebas para determinar cuál de las dos interpretaciones es exacta.
Una prueba de reducción de nitrato exitosa depende de la realización de la prueba en las condiciones correctas.
- La reacción se producirá mejor si el medio base soporta el crecimiento del organismo. Sin embargo, aunque algunas especies de Neisseria no crecen bien en medios de caldo, la prueba de reducción de nitrato puede realizarse con éxito en un medio que no soporte el crecimiento inoculando el medio en gran medida para proporcionar suficiente enzima preformada para que se produzca la reacción.
- La reacción de nitrato sólo se produce en condiciones anaeróbicas. El medio que contiene nitrato se dispensa en tubos para dar una baja relación superficie:profundidad que limita la difusión del oxígeno en el medio, por ejemplo, se dispensan 5 ml de medio en un tubo de 13 mm de diámetro. La Neisseria y las especies afines utilizan el oxígeno del medio y producen rápidamente condiciones anaeróbicas que son ideales para que se produzca la reducción del nitrato.
La prueba de reducción del nitrato se realiza en un medio que contiene 0,2% de nitrato de potasio. El medio se inocula fuertemente con un cultivo puro del organismo sospechoso y se incuba a 35C a 36,5C durante 48 h. en una incubadora con o sin dióxido de carbono suplementario.
La reducción de nitratos se detecta con los reactivos de Griess Llosvay, ácido sulfanílico y alfa-naftilamina. El ácido sulfanílico (reactivo de nitrato A) se añade a la mezcla de incubación y forma un complejo (nitrito-ácido sulfanílico) con cualquier nitrito presente en el medio. Cuando se añade alfa-naftilamina (reactivo de nitrato B) al medio incubado, se formará un precipitado rojo (prontosil) con cualquier complejo de ácido nitrito-sulfanílico presente en el medio.
Se puede informar de que un organismo es positivo al nitrato si se desarrolla un color rojo en el medio después de añadir los reactivos de nitrato A y B al medio, lo que indica que el organismo ha reducido el nitrato a nitrito.
La ausencia de un color rojo después de la adición de ambos reactivos no significa automáticamente que el organismo sea incapaz de reducir el nitrato. Las cepas pueden haber reducido el nitrato a nitrito, y luego haber reducido el nitrito completamente a gases nitrogenados que no se detectan cuando se añaden los reactivos de nitrato A y B al medio. Si el medio no cambia de color tras la adición del ácido sulfanílico y la alfa-naftilamina, se añade una pequeña cantidad («punta de cuchillo») de polvo de zinc al medio incubado. El polvo de zinc catalizará químicamente la reducción del nitrato a nitrito. Así, si el nitrato no ha sido reducido por los organismos, es decir, son nitrato-negativos, será reducido por el polvo de zinc y se desarrollará un color rojo en el medio incubado en 15 minutos. Si no se desarrolla ningún color en el medio incubado después de la adición de polvo de zinc, los organismos no sólo han reducido el nitrato a nitrito, sino que han reducido el nitrito a gases nitrogenados; estos organismos también son nitrato-positivos.
Aunque el medio de nitrato se suministra con tubos Durham invertidos para detectar la producción de gas, la producción de gas no se registra para las especies de Neisseria. Aunque algunas especies pueden reducir el nitrato más allá del nitrito a gases nitrogenados, el gas puede no acumularse en el tubo. La acumulación de gas depende de la velocidad a la que se produce. Cuando el gas se produce muy lentamente, puede disolverse en el medio y no acumularse en el tubo de Durham.
Requisitos de la muestra
Muestra óptima: Un cultivo puro de un diplococo gramnegativo sospechoso, oxidasa-positivo (Neisseria spp. o M. catarrhalis) en agar chocolate incubado en una atmósfera enriquecida con dióxido de carbono a 35C a 36,5C durante 18 a 24 h.
Espécimen inaceptable: Cultivos de aislados en agar chocolate incubados en una atmósfera enriquecida con dióxido de carbono a 35C a 36,5C durante más de 24 h.
Factores de riesgo que afectan a los resultados de la prueba:
- El medio de prueba debe inocularse con una cantidad suficiente para permitir que se produzca la reacción con las enzimas preformadas. Un inóculo insuficiente puede no permitir que los organismos utilicen el oxígeno para producir condiciones anaeróbicas en las que pueda producirse la reducción del nitrato.
- Demasiado polvo de zinc añadido al tubo incubado puede dar lugar a una reducción muy rápida del nitrato más allá del nitrito a gases nitrogenados de modo que no se detecte el nitrito.
Estabilidad de la muestra: La detección de la reducción del nitrato para Neisseria y especies afines depende de la presencia de enzimas preformadas.
- Las pruebas sólo deben realizarse con inóculo cosechado de cultivos de 24 h.
El medio de nitrato debe inocularse dentro de los 30 minutos siguientes a la extracción del cultivo de la incubadora; la exposición prolongada del cultivo a temperatura ambiente puede dar lugar a una disminución de la actividad enzimática.
Medio/reactivos
Medio: Caldo de nitrato (caldo de infusión de corazón que contiene 0,2% de nitrato de potasio)
Caldo de infusión de corazón (Difco), 25,0 g
Nitrato de potasio, 2,0 g
Agua destilada, 1000,0 ml
- Disolver los ingredientes en agua destilada; ajustar la solución a pH 7.0.
- Dispensar alícuotas de 5 ml del caldo en tubos de 16 mm x 100 mm con insertos de gas (tubos Durham, 6-mm x 50-mm).
- Autoclavar durante 15 min a 121C.
Guardar el medio a 4C a 10C (refrigerado) hasta su uso. Precalentar el medio a temperatura ambiente antes de la inoculación.
Reactivos: Solución de ácido sulfanílico (reactivo de nitrato A): 0,8% en ácido acético 5N
Nombre químico: Ácido 4-aminobenceno sulfónico
Almacenar el reactivo de nitrato A entre 15C y 30C (temperatura ambiente) hasta 3 meses, en la oscuridad. Los reactivos pueden almacenarse en recipientes de vidrio de color marrón oscuro; los frascos pueden envolverse en papel de aluminio para garantizar la oscuridad.
Solución de alfa-naftilamina (reactivo de nitrato B): 0,6% en ácido acético 5N
Nombre químico: N,N-dimetil-1 naftilamina
Conservar el reactivo de nitrato B entre 2C y 8C (refrigerado) hasta 3 meses, en la oscuridad. Los reactivos pueden almacenarse en recipientes de vidrio de color marrón oscuro; los frascos pueden envolverse en papel de aluminio para asegurar la oscuridad.
Polvo de zinc, grado de reactivo: Almacenar a temperatura ambiente (15C a 30C)
Advertencia: El ácido acético es corrosivo. El contacto con la piel puede causar ampollas y quemaduras. En caso de contacto, lavar inmediatamente los ojos y la piel con abundante agua (durante al menos 15 min.)
Procedimiento de control de calidad/prueba
Colores de control de calidad:
- Control positivo a la nitrato reductasa: Kingella denitrificans, CDC 10.236
- Control negativo para la nitrato reductasa: Neisseria gonorrhoeae, ATCC 43069
Las cepas de control se almacenan a -70C en una solución de caldo de soja tríptico que contiene 20% de glicerol. Las reacciones de las cepas de control deben confirmarse en el momento de preparar las existencias congeladas. Las cepas QC pueden almacenarse a -70C durante un máximo de 2 años.
Procedimiento:
Las cepas QC se analizan de la misma manera que los aislados clínicos. Las cepas QC deben subcultivarse al menos una vez después del cultivo inicial a partir de la muestra congelada antes de realizar la prueba. Los aislados clínicos pueden subcultivarse a partir de un medio selectivo o de subcultivos purificados. Asegúrese de que los cultivos sean puros.
- Congele viales de cepas de control almacenadas a -70C.
- Empareje en placas de agar chocolate o agar GC suplementado para el aislamiento. Incubar a 35C a 36,5C en una atmósfera enriquecida con dióxido de carbono durante 18 a 24 h.
-
Con un hisopo estéril, preparar una suspensión pesada de colonias bien aisladas de un cultivo puro del aislado incubado en medio chocolate a 35C a 36.5 C en una atmósfera enriquecida con dióxido de carbono durante 18 a 24 h. Inocular el medio de prueba para obtener una fuerte turbidez.
Nota: Las cepas de N. gonorrhoeae y algunas otras Neisseria spp. pueden no crecer en este medio. Por lo tanto, la reacción puede depender de la enzima preformada.
- Incubrir los medios inoculados y un tubo de medio de control sin inocular a 35C a 36,5 C en una atmósfera enriquecida con dióxido de carbono durante 48 h.
-
Después de 48 h. de incubación añadir, con pipetas Pasteur, 5 gotas de reactivo #A, seguidas de 5 gotas de reactivo #B a cada tubo. Agitar bien el tubo para mezclar los reactivos con el medio.
Examinar la suspensión en busca de un color rojo rosado que debería desarrollarse en pocos minutos si el medio está todavía caliente. La reacción puede tardar un poco más si el medio está frío cuando se añaden los reactivos.
Si la suspensión adquiere un color rojo rosado antes de la adición del polvo de Zn, la recación es positiva y la prueba se ha completado. No realice el paso 4.
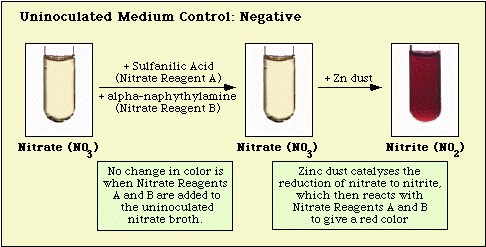
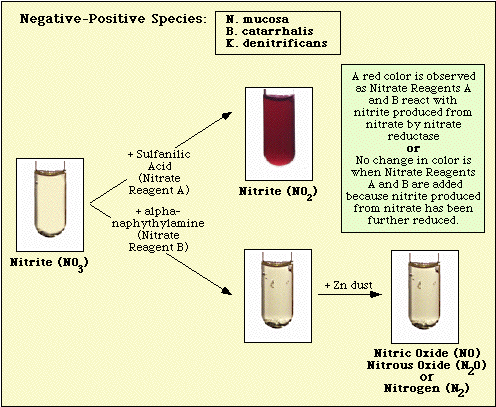
Las reacciones observadas con el control del medio sin inocular, y los aislados nitrato-negativos y nitrato-positivos se ilustran en la Figura 3, Figura 4 y Figura 5, respectivamente.
-
Si la suspensión es incolora después de la adición de los reactivos A y B, añada una pequeña cantidad (4 a 5 mg; «punta de cuchillo afilada») de polvo de zinc al medio. Agitar enérgicamente el tubo y dejarlo reposar a temperatura ambiente durante 10-15 minutos.
Si el medio permanece incoloro tras la adición del polvo de Zn, el resultado de la prueba es positivo.
Si el medio se vuelve rosa tras la adición del polvo de Zn, el resultado es negativo. - Leer y registrar los resultados.
Figura 3. Reacción observada con medio de nitrato no inoculado.
Figura 4. Reacción observada con especies negativas al nitrato.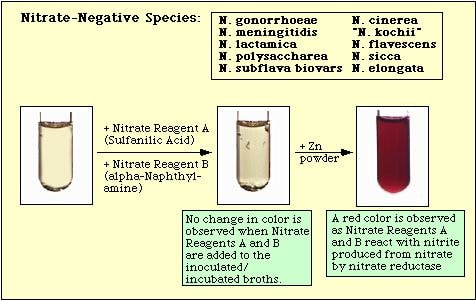
Figura 5. Reacciones observadas con especies positivas a los nitratos.
Programa de control de calidad:
- Se realiza una prueba de control de calidad de la nitrato reductasa cada día que se analizan los aislados clínicos.
Problemas &Soluciones
La prueba de reducción de nitratos puede dar resultados falsos negativos o falsos positivos si el medio no se produce con precisión o la prueba no se realiza con exactitud. La reacción en esta prueba depende de una serie de factores.
- El hecho de que no se detecte color rosa en el tubo de control del medio no inoculado tras la adición de polvo de Zn puede deberse (1) a que el medio no contenga nitrato o (2) a la adición de demasiado polvo de zinc que ha catalizado la reducción del nitrato más allá del nitrito a gases nitrogenados. La solución más sencilla es obtener más medio con nitrato asegurándose de que se ha añadido nitrato al medio base. Otra posibilidad es inocular el medio con una cepa de control positivo, pero comprobar si hay reacción tras un tiempo de incubación más corto; las cepas de N. mucosa producirán una reacción positiva de nitrito tras unas horas de incubación. Si se confirma que el medio contiene nitrato, repita la prueba hasta que haya determinado la cantidad correcta de polvo de zinc que debe añadir. Es fundamental conocer la cantidad de polvo de zinc que hay que añadir a la prueba. La adición de demasiado polvo de zinc puede dar lugar a un resultado falso-positivo.
- Si se detecta un color rosa en el control del medio no inoculado después de añadir los reactivos de nitrato A y B al medio, éste está contaminado con nitrito. La única solución es obtener un nuevo lote de medio que no esté contaminado con nitrito.
- En el medio que contiene nitrato, el fracaso de la cepa de control positivo, Kingella denitrificans, para dar una reacción positiva sólo ocurriría si la cepa no es K. denitrificans. Vuelva a comprobar la identidad de la cepa de control positivo. Seleccione un nuevo cultivo de la cepa de control y repita la prueba. Del mismo modo, si se obtiene una prueba de nitrato reductasa positiva con la cepa de control negativa, N. gonorrhoeae, o bien la cepa de control negativa no es N. gonorrhoeae o bien el cultivo está contaminado con un organismo positivo al nitrato. Volver a comprobar la pureza y la identidad de la cepa gonocócica de referencia. Repita la prueba con un cultivo puro de un cultivo confirmado de N. gonorrhoeae.
- La reacción de reducción de nitrato indica la capacidad de los organismos para reducir el nitrato, una reacción que sólo se produce en condiciones anaeróbicas; la reacción no se producirá si los organismos reciben un suministro continuo de oxígeno. Por lo tanto, la reacción puede no producirse en cultivos tranquilos (especialmente de especies de crecimiento lento) en los que el medio está distribuido en capas poco profundas que permiten que el oxígeno se difunda en el medio. Una prueba para determinar si el oxígeno está presente en el medio puede hacerse añadiendo una gota de reactivo de oxidasa al medio. Si el medio se vuelve púrpura, el medio contiene oxígeno y la reacción de reducción de nitratos puede no ocurrir. Si el medio permanece incoloro, el medio no contiene oxígeno y puede producirse la prueba de reducción de nitratos. Se ha observado que las células de N. gonorrhoeae utilizan el oxígeno rápidamente si se inoculan suficientes células en el medio. Si se añade el reactivo de oxidasa después de aproximadamente 1 a 2 horas de incubación, el medio permanecerá claro. Debido a que el reactivo de oxidasa mata a los gonococos presentes en el medio, el medio se tornará gradualmente púrpura, comenzando en la parte superior del tubo, a medida que el oxígeno se difunde en el medio. Si el medio se dispensa en tubos de dimensiones diferentes a las sugeridas anteriormente, asegúrese de que la relación superficie-profundidad sea al menos igual o menor que las sugeridas anteriormente. Si el diámetro del tubo en el que se dispensa el medio es mayor que el descrito anteriormente, utilice un volumen mayor de medio para mantener la misma relación superficie-profundidad.
-
La reacción de reducción de nitratos puede no producirse si el medio en el que se realiza la prueba no permite el crecimiento normal del organismo. Sin embargo, la prueba puede realizarse en un medio que no permita el crecimiento de los organismos si el inóculo es lo suficientemente denso como para que las enzimas preformadas puedan agotar el suministro de oxígeno existente y reducir el nitrato a una velocidad más rápida que la de difusión del oxígeno en el medio.
Nota: Para comprobar que el oxígeno se ha eliminado del medio, añada de 2 a 3 gotas de reactivo de oxidasa a un duplicado del medio inoculado. Si el oxígeno se ha eliminado adecuadamente del medio, el reactivo de oxidasa no se volverá púrpura inmediatamente. Si el medio contiene oxígeno disuelto, el reactivo de oxidasa se volverá púrpura. Obsérvese también que la prueba de reducción de nitrato puede realizarse en un medio al que se ha añadido el reactivo de oxidasa.
- Cuando se añade el reactivo A al medio de prueba, el nitrito producido como resultado de la reducción del nitrato formará un complejo con el ácido sulfanílico que produce un precipitado rojo con la alfa-naftilamina del reactivo B. La presencia de un color rojo en el medio de prueba indica que hay nitrito como resultado de la reducción del nitrato. Sin embargo, la ausencia de un color rojo tras la adición de los reactivos A y B no significa necesariamente que el nitrato no se haya reducido. La ausencia de color rojo puede significar (1) que el nitrato no se redujo, o (2) que el nitrito, producido como resultado de la reducción del nitrato, se ha reducido a su vez a gases nitrogenados. Para determinar si el nitrito se ha reducido, coloque una pequeña cantidad de polvo de zinc en la mezcla de incubación si ésta es incolora después de la adición de los reactivos A y B. El polvo de zinc cataliza la reducción del nitrato a nitrito; debe desarrollarse un color rojo en el medio que todavía contiene nitrato no reducido. Sin embargo, es importante no añadir demasiado polvo de zinc; un exceso de polvo de zinc catalizará la reducción del nitrito producido a partir de ese nitrato, lo que dará lugar a un medio incoloro y a la interpretación incorrecta de la prueba como positiva (un resultado falso-positivo).
- Una prueba positiva de nitrato reductasa se obtiene con la cepa de control negativa, N. gonorrhoeae, después de la adición del polvo de zinc indica que el nitrato se ha reducido más allá del nitrito, probablemente debido a la adición de demasiado polvo de zinc a la prueba. Repita la prueba asegurándose de añadir muy poco polvo de zinc. El color rosa, que indica que el organismo no ha reducido el nitrato, puede tardar de 10 a 15 minutos en desarrollarse. No añada más polvo de zinc. Espere a que el color se desarrolle. Si no se ha desarrollado ningún color en 30 minutos, interprete la prueba como positiva.
Limitaciones de la prueba
Si la prueba se realiza correctamente y las cepas de control de calidad dan resultados adecuados, no debería haber limitaciones para esta prueba. Debe tenerse cuidado para garantizar que todos los componentes de la prueba se realicen correctamente.
No puede realizarse ninguna identificación de género o especie basándose únicamente en la prueba de reducción de nitratos.
Resultados, interpretación y presentación de informes
Los aislados pueden notificarse como Nitrato-positivos si se detecta nitrito (color rosa) en el medio inoculado tras la adición de los reactivos A y B o si no se detecta color en el medio tras la adición de polvo de zinc.
Los aislados pueden notificarse como Nitrato-negativos si no se detecta nitrito (no hay cambio de color) tras la adición de los reactivos A y B, o si se desarrolla un color rosa tras la adición de polvo de zinc al medio inoculado.
Bibliografía
Knapp JS, Clark VL. Crecimiento anaeróbico de Neisseria gonorrhoeae acoplado a la reducción de nitritos. Infect Immun 1984;46:176-181.
Skerman VBD. 1967. p.218 – 220. Una guía para la identificación de los géneros de bacterias. The Williams & Wilkins Co., Baltimore, MD.