La guanosina trifosfato (Guanosina-5′-trifosfato para ser precisos o también comúnmente abreviado GTP para simplificar) es un nucleótido de alta energía (no confundir con nucleósido) que se encuentra en el citoplasma o polimerizado para formar la base de guanina.
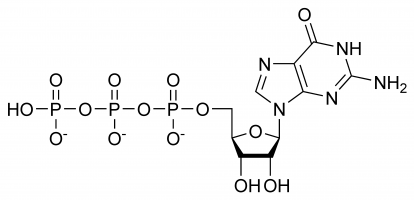
El GTP tiene papeles selectivos en la formación de hebras de ARN, funcionando como una molécula portadora de energía para la síntesis de proteínas, una coenzima, un predecesor del GMPc – una molécula mensajera secundaria o como una molécula efectora. Las dos últimas se demuestran comúnmente mediante la modulación de la proteína G. Todo ello se debe a su compleja estructura tridimensional y a la variedad de grupos químicos que la componen. Por lo tanto, para simplificar, puede considerarse como una multitud de grupos funcionales diferentes que prácticamente desempeñan funciones distintas de forma aislada (aunque a veces la estructura interviene, por ejemplo, cuando interactúa con una enzima y otro sustrato), por ejemplo, sólo el trifosfato participa en la liberación de energía para la polimerización, mientras que sólo la base de guanina participa en su desaminación. Es importante notar que la lista dada al principio no exhala sus interacciones químicas pero es simplemente una demostración de sus varias capacidades.
En el GTP el azúcar ribosa es central en la disposición tridimensional de las moléculas de guanina y trifosfato unidas covalentemente. Este monosacárido proporciona grupos hidroxilos para las reacciones de condensación y los ataques nucleófilos, este último importante para la destrucción de las moléculas de ARN y, por tanto, para la regulación de la expresión génica. La molécula de guanina y el trifosfato forman enlaces covalentes en los átomos C’1 y C’5 respectivamente, sin embargo, también es posible que utilicen otros grupos hidroxilos siempre que la estructura resultante no provoque choques. Desde el punto de vista de la purina se une como resultado de una reacción de condensación en su 9’N, que previamente había estado unido covalentemente a un átomo de hidrógeno. Como la guanina es una base de purina, se clasifica como un trifosfato de purina junto con el trifosfato de adenina (ATP) y se forma a través de la modificación del monofosfato de inosina.
Contenido
- 1 Concepto erróneo: GTP, un bloque de construcción básico
- 2 Uno de los muchos predecesores de las bases del ARN
- 3 GTP; un primo del ATP universal
- 4 Un recurso para la señalización
- 5 Referencias
Concepto erróneo: GTP, un bloque de construcción básico
El hígado es el principal órgano que sintetiza los nucleótidos de purina y piramidina. Los nucleótidos de purina (GTP y ATP) se sintetizan creando primero monofosfato de inosina a partir de ATP, glutamina, glicina, CO2, aspartato y formiato. El IMP
puede entonces ser modificado para producir cualquiera de las moléculas.
En el caso de la formación de GTP el IMP se convierte primero en XMP por la IMP deshidrogenasa. El cambio químico y estructural resultante permite la acción de la GTP sintasa que convierte rápidamente el XMP en GMP. Sin embargo, el GMP no es una molécula de alta energía, ya que no posee un trifosfato, por lo que es fosforilado por las nucleósido fosfato quinasas para producir primero un difosfato y finalmente un trifosfato.
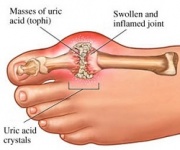
El GTP se cataboliza normalmente en ácido úrico insoluble que puede aparecer en la orina en forma de cristales de urato sódico. Este proceso se considera anormal si tiene lugar en las articulaciones sinoviales, dando lugar a ácido úrico que luego se convierte en el dañino urato monosódico o pirofosfato cálcico dihidratado. La presencia de estas sustancias químicas permite el desarrollo de la inflamación y la artritis, y los síntomas combinados conducen a la clasificación de la enfermedad como gota. Otro ejemplo de la importancia del catabolismo adecuado de los nucleótidos de purina es la Enfermedad de Inmunodeficiencia Combinada Grave, que da lugar a la destrucción de los linfocitos B y T esenciales
Uno de los muchos predecesores de las bases del ARN
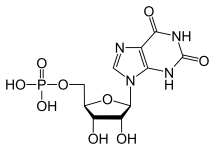
Hay varias diferencias entre el ARN y el ADN, pero la distinción principal está en la estructura de las nucleobases que construyen cada polímero. Las nucleobases del ARN contienen un grupo 2’OH en su azúcar ribosa que les permite ser significativamente más reactivas químicamente, catalíticas e inestables. Es importante señalar que el trifosfato de guanosina sólo se ocupa de la producción de la base de guanina en el ARN. El análogo del GTP para la formación de una base de guanina en el ADN es el trifosfato de desoxiguanosina. Este trifosfato contiene un azúcar desoxirribosa sin un grupo
2’OH que lo hace significativamente más estable – impidiendo los ataques nucleófilos que escindirían los enlaces fosfodiéster entre las nucleobases. Esto es ideal, ya que el ARN debe desintegrarse después de haberse traducido en una proteína, mientras que el ADN tiene que permanecer intacto para el paso de la información genética a la célula hija.
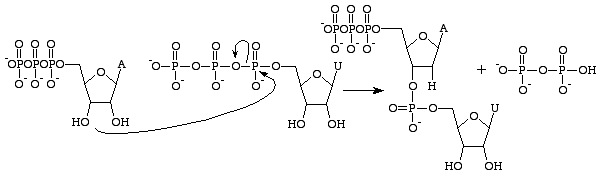
El trifosfato de guanosina dará lugar a la formación de una base de guanina como resultado de la escisión de un enlace anhídrido y la liberación de fosfatos alfa y gamma como fosfatos libres. El GMP formará entonces un enlace fosfodiéster con la base cercana que contiene un grupo 3’OH, y suministrará un grupo 3’OH para la siguiente base de ARN. Esta reacción sólo se produce si la base opuesta al GMP es la citosina, con la que puede formar enlaces de hidrógeno, y su velocidad se ve incrementada por la ARN polimerasa. La ARN polimerasa no alinea los trifosfatos. Se limita a catalizar la reacción que se produce después de hacerlo de forma independiente. Después de la catálisis, la molécula forma parte de una cadena de polinucleótidos y ya no se conoce como GTP, sino como la base guanina.
GTP; un primo del ATP universal
El mecanismo subyacente de obtención de energía a partir de la escisión del enlace anhídrido es el mismo en todos los trifosfatos. El estado de alta energía de los trifosfatos se logra a través de tres mecanismos distintos. El primero se debe a las fuerzas de repulsión
en cada uno de los grupos fosfato. Esto contribuye a una alta inestabilidad de los trifosfatos enlazados y a un alto «deseo» de alcanzar un estado energético más bajo. La segunda se debe a la estabilización por resonancia. Cuando el GTP es
convertido en GDP la cantidad de posiciones posibles para los pares de electrones existentes se incrementa, prestando una mayor estabilidad. Este argumento también se sostiene con la conversión de GDP en GMP. El tercero se debe al efecto entrópico desfavorable que una mayor cantidad de fosfatos tiene sobre la conformación de las moléculas de agua que rodean la molécula.
Como la concentración de GTP en el citoplasma es significativamente menor que la de ATP, se utiliza para funciones específicas en los procesos metabólicos celulares.
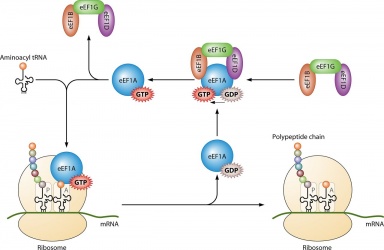
Su uso principal es en la síntesis de proteínas cuando se acopla con IF2 durante la iniciación ribosomal, Ef-Tu y Ef-G durante la elongación y ;RF3 durante la terminación. Todas las moléculas de GTP que se unen a las proteínas mencionadas se desfosforilan, dando lugar a GDP y a un fosfato libre
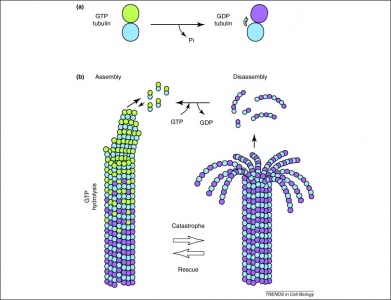
Además, el GTP también es utilizado por los dímeros de tubulina en su formación de microtúbulos. Los dímeros de tubulina se componen de tubulina alfa y beta, cada una de las cuales posee sitios de unión a GTP. Dado que la tubulina beta se encuentra en el extremo positivo del filamento, el GTP siempre se hidroliza aquí cuando se añade otro dímero al polímero que se alarga. Es importante destacar que la hidrólisis de GTP debilita las interacciones no covalentes entre los dímeros de tubulina, lo que facilita la disolución de los microtúbulos cuando es necesario. Tenga en cuenta que el GTP de la proteína de la tubulina alfa no está desfosforilado por lo que se puede considerar que es consistente a través de la estructura de los microtúbulos.
Un recurso para la señalización
El uso de la química específica y la conformación espacial de GTP se demuestra efectivamente por su uso en la transmisión de señales. Principalmente, es capaz de unirse y regular la actividad de diferentes proteínas de la vía de señalización que se clasifican en dos grupos diferentes. El primero son las proteínas heterotriméricas de unión a GTP (también conocidas como proteínas G heterotriméricas) que utilizan el GTP tras la activación de los receptores acoplados a proteínas G para modificar la actividad de otras proteínas de la vía. La segunda son las proteínas monoméricas de unión a GTP (también conocidas como proteínas G monoméricas). Éstas responden a receptores distintos de los receptores acoplados a proteínas G. Un ejemplo típico citado durante su explicación es la proteína Ras. Obsérvese que son capaces de unir selectivamente el GTP bno sólo por su química específica sino también por el fenómeno de ajuste inducido. El GTP unido será entonces hidrolizado después de un cierto período de tiempo y por lo tanto resultará en una auto-inactivación de la proteína y la prevención de la estimulación excesiva de una vía de señalización. Tras la hidrólisis del GTP, el GDP permanecerá unido, ya que el cambio conformacional dará lugar a un cambio de afinidad hacia la molécula de GTP y la molécula de GDP. Sin embargo, se trata de un cambio imperativo y puede ser revertido por la activación posterior del receptor acoplado a la proteína G.
El GTP también puede utilizarse como reactivo para producir GMPc, que es una molécula de señalización secundaria relativamente común. La catálisis se desencadena por la liberación de NO que activa la guanilato ciclasa, una enzima que produce cGMP a partir de GTP. El cGMP puede entonces actuar como efector hacia las proteínas quinasas que fosforilan y modifican la acción de proteínas específicas.
- J Koolman y KH Roehm, Color Atlas of Biochemistry, 3ª edición, Stuttgart, Alemania. Thieme 2013.
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell y P A Weil. Bioquímica ilustrada de Harper. 28ª edición. Beijing, China. 2009.
- J Dow, G Lindsay y J Morrison, Biochemistry: Moléculas, Células y el Cuerpo. 1st Edition. Wokingham, Inglaterra. Addison-Wesley. 1996.
- J Dow, G Lindsay y J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, Inglaterra. Addison-Wesley. 1996.
- J Dow, G Lindsay y J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, Inglaterra. Addison-Wesley. 1996.
- J Koolman y KH Roehm, Color Atlas of Biochemistry, 3ª Edición, Stuttgart, Alemania. Thieme 2013.
- J Koolman y KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- M W King. La página de bioquímica médica. Septiembre de 2016. Citado: 11:31. 03.12.2016. Disponible en: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell y P A Weil. Bioquímica ilustrada de Harper. 28th Edition. Beijing, China. 2009.
- M W King. La página de bioquímica médica. Septiembre de 2016. Citado: 11:31. 03.12.2016. Disponible en: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. La página de bioquímica médica. Septiembre de 2016. Citado: 11:31. 03.12.2016. Disponible en: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. La página de bioquímica médica. Septiembre de 2016. Citado: 11:31. 03.12.2016. Disponible en: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. La página de bioquímica médica. Septiembre de 2016. Citado: 11:31. 03.12.2016. Disponible en: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- J Dow, G Lindsay y J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, Inglaterra. Addison-Wesley. 1996.
- J Dow, G Lindsay y J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, Inglaterra. Addison-Wesley. 1996.
- J Dow, G Lindsay y J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, Inglaterra. Addison-Wesley. 1996.
- J Koolman y KH Roehm, Color Atlas of Biochemistry, 3ª Edición, Stuttgart, Alemania. Thieme 2013.
- J M Berg, J L Tymoczko, G J Gatto y R Stryer. Bioquímica. Octava edición. Ciudad y país no identificados. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto y R Stryer. Bioquímica. Octava edición. Ciudad y país no identificados. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto y R Stryer. Biochemistry. Octava edición. Ciudad y país no identificados. Freeman and Co. 2015.
- T E Dever y R Green. Las fases de Elongación, Terminación y Reciclaje en Eucariotas. CSHPB. Julio 2012. 4:7:1-16
- B Alberts et al. Molecular Biology of The Cell (Biología molecular de la célula). 6ª edición. New York, USA. Garland Science. 2015.
- B Alberts. Molecular Biology of The Cell. 6ª edición. New York, USA. Garland Science. 2015.
- J Koolman y KH Roehm, Color Atlas of Biochemistry, 3ª Edición, Stuttgart, Alemania. Thieme 2013.
- J Koolman y KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Alemania. Thieme 2013.
- J Koolman y KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Alemania. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.