- Introducción: Clínica de la migraña
- Patofisiología de la migraña y el péptido relacionado con el gen de la calcitonina (CGRP)
- Intervenciones farmacológicas en la vía del CGRP
- Relación farmacocinética (PK)/farmacodinámica (PD) de los mAbs antimigrañosos
- Conclusión
- Contribuciones de los autores
- Declaración de conflicto de intereses
Introducción: Clínica de la migraña
La migraña consiste en una cefalea unilateral acompañada de un conjunto de otros síntomas sensoriales, autonómicos y cognitivos y ha sido identificada por el estudio de la carga global de la enfermedad (GBD) 2016 como el sexto trastorno más prevalente y una de las principales causas de discapacidad en todo el mundo, presentándose con frecuencia en la edad laboral y en mujeres adultas jóvenes y de mediana edad (Colaboradores, 2018). Por lo tanto, la migraña representa un problema social muy grave en términos de años de vida vividos con discapacidad (YLD) y la causa más importante de YLD dentro de los 15 a 49 años de edad (véase Steiner et al., 2018). La carga de dicha enfermedad no se ha identificado hasta hace poco porque: la migraña no es una causa de discapacidad permanente o muerte; la cefalea se presenta ocasionalmente en la población general (Colaboradores, 2018). Aunque no se conoce una patogénesis definida para la migraña, la circulación extracraneal está implicada (Drummond y Lance, 1983). El curso clínico de la migraña se articula en diferentes etapas siguientes o concomitantes: premonitoria, aura, cefalea y postdromo (similar a la fase premonitoria) (Goadsby et al., 2017a). La fase premonitoria incluye irritabilidad, ansiedad por la comida, rigidez de cuello y puede ocurrir de 2 a 72 h antes del ataque y continúa sobre las otras fases. Según las definiciones de la Clasificación Internacional de las Cefaleas tercera edición (ICHD-3):
– el aura se caracteriza por uno o más déficits neurológicos transitorios y reversibles, de los cuales al menos uno tiene que ser de localización unilateral, que se desarrollan a lo largo de 5 min o más y de los cuales cada déficit dura entre 5 y 60 min;
– la migraña consiste en ataques de cefalea que duran entre 4 y 72 h acompañados de náuseas, fotofobia y fonofobia, o ambas cosas (véase Goadsby et al., 2017a).
La alodinia cutánea, definida como la percepción de dolor tras estímulos no dolorosos, se produce en más del 70% de los pacientes (Lambru et al., 2018). La cefalea severa se atenúa hasta detenerse durante la fase postdromo, mientras que otros síntomas como la astenia, la somnolencia y la fotofobia siguen afectando al paciente, mostrando así la compleja base neural que subyace a la migraña (Lambru et al., 2018). En función de los días al mes afectados, la migraña se clasifica como episódica (menos de 15 días de migraña o cefalea) o crónica (al menos 15 días, entre los cuales 8 o más son de migraña) (véase Goadsby et al., 2017b). Este aspecto influye notablemente en el impacto de la enfermedad y en las opciones terapéuticas (Giamberardino et al., 2017). Con 1 a 3 ataques al mes es posible utilizar solo fármacos sintomáticos abortivos, mientras que si se producen de 4 a 14 ataques al mes es obligatorio añadir tratamientos preventivos; estos últimos tratamientos son necesarios para evitar la cronificación de la enfermedad (Giamberardino y Martelletti, 2015; Giamberardino et al., 2017) y para reducir el riesgo de cefalea por exceso de medicación y de migraña refractaria (Martelletti, 2017).
Patofisiología de la migraña y el péptido relacionado con el gen de la calcitonina (CGRP)
La causa exacta de los ataques de migraña aún no se conoce bien, pero las investigaciones actuales han ido destacando la importancia de los procesos de sensibilización dentro del sistema trigeminovascular y de todo el tronco encefálico, así como la observación de la reducción de la materia gris en las áreas de procesamiento del dolor (véase Goadsby et al, 2017a). Desde el ganglio del trigémino que contiene el cuerpo celular los aferentes primarios pseudounipolares hacen sinapsis en los vasos sanguíneos y en el complejo trigeminocervical desde el que las fibras de segundo orden hacen sinapsis en las neuronas talamocorticales de tercer orden y en el locus coeruleus, el gris periacueductal y el hipotálamo (Goadsby et al., 2017a). Las fibras nociceptivas del ganglio del trigémino y los ganglios de la raíz dorsal cervical inervan los vasos de la duramadre y sus terminales liberan neuropéptidos vasoactivos como el péptido relacionado con el gen de la calcitonina (CGRP) que inducen la vasodilatación. La expresión de CGRP, CLR y RAMP1 en los vasos de la duramadre humana se muestra en las figuras 1A-C. De hecho, las fibras nerviosas autónomas que inervan la vasculatura extracerebral contienen varias moléculas neurotransmisoras vasoactivas: noradrenalina, serotonina, acetilcolina, neuropéptido Y (NPY), polipéptido intestinal vasoactivo (VIP), sustancia P (SP), neuroquinina A (NU) y CGRP (Goadsby et al., 1990). Los antagonistas de los receptores del CGRP actúan bloqueando la información nociceptiva procedente de la duramadre: se procesa en los núcleos talámicos desde los que llega a regiones corticales superiores. Estas entradas del sistema trigeminovascular están sometidas a la modulación de la vía descendente del tronco del encéfalo: se cree que los agonistas de los receptores de la 5-hidroxitriptamina (5HT)1B/1D, es decir, los triptanes, actúan a través de este sistema y contrarrestan la vasodilatación producida. Mientras que el propranolol y el topiramato se utilizan como tratamiento preventivo, estos últimos fármacos se emplean en los episodios agudos de migraña. En particular, además de su actividad vasoconstrictora, los triptanes que actúan directamente sobre los receptores presinápticos 5HT1B/D inhiben la liberación de mediadores como el CGRP, implicados en la nocicepción. Además, se ha demostrado experimentalmente que el sumatriptán inhibe la corriente entrante mediada por el receptor potencial transitorio vanilloide 1 (TRPV1) en los ganglios del trigémino (Evans et al., 2012). El CGRP se libera durante los ataques de migraña y desempeña varias funciones como el neuropéptido más vasoactivo cuyos niveles craneovasculares aumentan en el curso del trastorno (Goadsby et al., 1990). Se ha demostrado que el CGRP también sufre alteraciones en el líquido cefalorraquídeo (van Dongen et al., 2017). Los factores desencadenantes de la alteración de la excitabilidad central y la posterior irrupción de los episodios de dolor migrañoso se han investigado durante mucho tiempo. La estimulación de las fibras nerviosas puede fomentar potenciales de acción tanto ortodrómicos como antidrómicos y, en particular, la activación de los aferentes sensoriales primarios durales peptidergicos que expresan el potencial receptor transitorio (TRP) puede inducir la liberación de varias moléculas, incluido el CGRP, que desencadenan reacciones tisulares inflamatorias conocidas como inflamación neurogénica (Xanthos y Sandkuhler, 2014). En particular, el CGRP está implicado en la nocicepción craneal y en el epifenómeno de la vasodilatación que une sus receptores en los vasos sanguíneos meníngeos y cerebrales (Deen et al., 2017). Estos procesos promueven la sensibilización de las fibras trigeminales de segundo orden llevando los estímulos dolorosos amplificados a regiones superiores como el tálamo, el hipotálamo y la corteza, originando así la migraña (Dussor et al., 2014). Los TRP se activan en respuesta a varios estímulos ambientales irritantes, como las variaciones de temperatura y de pH, que en individuos predispuestos pueden desencadenar el dolor de la migraña. El CGRP se produce por empalme alternativo específico de tejido del gen de la calcitonina CALC I en el cromosoma 11, que también codifica para la calcitonina. Por el contrario, el β CGRP se produce a partir del gen CALC II situado en un lugar diferente del cromosoma 11. El neuropéptido α CGRP está presente en el sistema nervioso central como isoforma α de 37 aminoácidos y su transducción de señales está mediada por dos receptores.
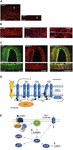
Figura 1. Aparición y vía del CGRP en la migraña. Expresión de CGRP, CLR y RAMP1 en los vasos de la duramadre humana: (A) La inmunoreactividad del CGRP se encuentra en las fibras finas de la adventicia; (B) secciones transversales y longitudinales que muestran la expresión de RAMP1 en el citoplasma de las células musculares lisas; (C) coexpresión de CLR y RAMP1 en la capa de células musculares lisas. (D) Componentes del receptor CGRP y residuos importantes para la señalización e internalización del receptor. El receptor CGRP está formado por CLR (azul), RAMP1 (amarillo) y RCP (naranja). Los residuos funcionalmente importantes se muestran como abreviaturas de una sola letra. Los residuos de aminoácidos están numerados desde el inicio del péptido señal N-terminal previsto (Swiss-Prot Q16602). Varios aminoácidos dentro del C-terminal del CGRP (∼N400-C436) e I312 en la unión ICL3/TM5 son necesarios para la internalización efectiva mediada por el CGRP. Se ilustran características importantes del receptor CGRP, incluyendo el «pliegue» TM6 (P343) y la putativa octava hélice (∼G388-W399) en CLR. C′, C-terminal; ECL, bucle extracelular; ICL, bucle intracelular; N′, N-terminal; TM, transmembrana. (E) Señalización intracelular mediada por el receptor CGRP: La señalización Gαs aumenta la actividad de AC (verde), elevando el AMPc intracelular, activando la PKA y, posteriormente, muchos posibles efectores aguas abajo. Los paneles (A-C) son una adaptación de Eftekhari et al. (2013) y el panel (D,E) de Walker et al. (2010), respectivamente, con permiso.
El primero se conoce como receptor CGRP canónico y es un receptor acoplado a la proteína Gαs que requiere la proteína modificadora de la actividad del receptor (RAMP) 1 para ser funcional (Goadsby et al., 2017a). El segundo es el receptor humano del subtipo 1 de la amilina (AMY1): la amilina pertenece a la familia de genes de la calcitonina y tiene actividad hormonal. Cuando el CGRP se une a su receptor, se somete a una internalización dependiente de la dinamina/clatrina tras haberse acomplejado con la β-arrestina (véase Walker et al., 2010). Se producen cambios conformacionales que inducen la activación de la adenilato ciclasa (AC), el aumento del AMPc y la activación de la proteína quinasa A (PKA) que puede promover la vasodilatación a través de la activación directa de la óxido nítrico sintasa endotelial y las respuestas al dolor. Este último receptor puede acoplarse a Gαq/11 con la activación de la fosfolipasa C (PLC), a la proteína quinasa activada por mitógenos (MAPK) y a la liberación de NO (véase Walker et al., 2010) (véase la representación esquemática de la señalización intracelular mediada por el receptor CGRP en las figuras 1D,E). La administración de CGRP a los migrañosos desencadena los ataques y esta evidencia apoya su papel fundamental en la patogénesis de la migraña (Lassen et al., 2002). Todavía no se ha identificado un sistema de terminación de la señal: El CGRP es metabolizado por la neprilisina, la enzima degradante de la insulina y la enzima convertidora de endotelina-1 y se ha planteado la hipótesis de un sistema de transporte activo de recaptación (véase Russell et al., 2014). Además, cuando el receptor es activado transitoriamente por el CGRP se internaliza en endosomas y se recicla rápidamente de vuelta a la membrana celular, mientras que la estimulación crónica del receptor induce la desensibilización y la degradación lisosomal (véase Russell et al., 2014).
Intervenciones farmacológicas en la vía del CGRP
La migraña es un trastorno neurovascular incapacitante multifacético y la terapia actual con triptanes orales es eficaz en los ataques agudos, aunque un 40% de los pacientes son resistentes al tratamiento (Ferrari et al., 2001; Edvinsson, 2015). Estos agonistas selectivos 5-HT1B/1D, de los cuales el más utilizado es el sumatriptán, principalmente activo por vía subcutánea, ejercen su acción terapéutica a través de la vasoconstricción de los vasos craneales y la inhibición del sistema trigeminal y trigeminocervical (véase Ferrari et al., 2001). Sin embargo, la vasoconstricción representa un límite para los efectos secundarios cardiovasculares de estos fármacos. Además, el tratamiento con triptanes no puede durar más de 9 días al mes debido al riesgo de cefalea inducida por el fármaco. En 2010 la toxina botulínica tipo A (BoNT-A) fue aprobada por la Food and Drug Administration (FDA) en la prevención de la migraña en los migrañosos crónicos que no responden y su compleja administración (requiere la inyección en 31 sitios) limita el cumplimiento de los pacientes. Debido al papel fundamental que desempeña el CGRP en la fisiopatología de la migraña, se han desarrollado antagonistas de su receptor. Estos fármacos pertenecen a la clase de los gepants. Telgecepant, el primer gepante oral, resultó bien tolerado en migrañosos afectados por enfermedad arterial coronaria (ClinicalTrials.gov NCT00662818, Ho et al., 2012), pero presentó hepatotoxicidad, por lo que, a pesar de la continua investigación sobre estas pequeñas moléculas, se propuso un nuevo enfoque consistente en el desarrollo de anticuerpos monoclonales (mAbs) hacia el CGRP (nezumabs) o el receptor del CGRP (numabs). Se cree que estos fármacos inhiben la acción de las moléculas de CGRP circulantes para prevenir los ataques de migraña y, dado que no atraviesan la barrera hematoencefálica (BBB) debido a su tamaño, los sitios de acción deberían estar en el sistema trigeminal (Edvinsson, 2015). En particular, los vasos durales no están incluidos en la BBB. Además, es probable que el CGRP no atraviese la BBB y actúe como modulador paracrino, ya que es expresado por la mitad de las neuronas del ganglio del trigémino que no presentan el receptor CGRP, expresado por las células gliales satélites y el 30% del soma neuronal del ganglio del trigémino (véase Yuan et al., 2017). Actualmente, hay cuatro mAbs, eptinezumab, fremanezumab, galcanezumab y erenumab estudiados en ensayos clínicos para la migraña episódica y crónica. Los tres primeros mAbs son anticuerpos humanizados dirigidos contra el CGRP, mientras que el erenumab es un anticuerpo humano contra su receptor canónico. La vida media de estos fármacos es bastante larga, por lo que no permite más de una administración al mes y esto es un asunto de interés, ya que los mAbs deben administrarse por vía intravenosa o subcutánea. En concreto, el eptinezumab solo se administra por vía intravenosa (Israel et al., 2018). El ensayo de fase III PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) (ClinicalTrials.gov NCT02559895) evaluó la eficacia de eptinezumab en la prevención de la migraña episódica frecuente. Los resultados mostraron una reducción significativa del criterio de valoración primario consistente en la disminución de los días de migraña mensuales (DMM) desde una media basal de 8,5 días a lo largo de las semanas 1 a 12 a 4,3 DMM con la dosis de 300 mg, 3,9 con 100 mg y 4,0 con 30 mg respecto a 3,2 días de placebo (Saper et al., 2018). Para la evaluación de eptinezumab en la prevención de la migraña crónica se han inscrito 1121 participantes en el PROMISE 2 (ClinicalTrials.gov NCT02974153). Se evaluó la eficacia de galcanezumab en la prevención de la migraña episódica en el estudio EVOLVE-1 de fase 3, doble ciego, aleatorizado y controlado con placebo (ClinicalTrials.gov NCT02614183), diseccionado en 4 periodos, y en el ensayo clínico EVOLVE-2 de fase 3, aleatorizado, controlado, doble ciego y de 6 meses de duración (ClinicalTrials.gov NCT02614196). En el EVOLVE-1 ambas dosis de galcanezumab (120 y 240 mg) cumplieron el resultado primario de reducción significativa de los días de cefalea migrañosa mensual de 4,7 días y 4,6 días, respectivamente, en comparación con los 2,8 días del placebo (Stauffer et al., 2018). En el EVOLVE-2 los pacientes recibieron una inyección mensual de 120 o 240 mg de galcanezumab. La media de días mensuales de cefalea migrañosa se redujo en 4,3 y 4,2 días, respectivamente, en comparación con la reducción de 2,3 días obtenida con el placebo (p < 0,001) (Skljarevski et al., 2018). También se cumplieron los criterios de valoración secundarios de reducción del deterioro funcional evaluado a través de la puntuación del dominio Role Function-Restrictive (R-FR) del Cuestionario de Calidad de Vida Específico para la Migraña (MSQ) y la mejora de la puntuación de la Impresión Global de la Gravedad del Paciente (PGI-S) y de la Evaluación de la Discapacidad de la Migraña (MIDAS; punto temporal = mes 6) (Skljarevski et al., 2018). 147 (65,0%) y 163 (71,5%) de los pacientes tratados con galcanezumab, 120 y 240 mg, respectivamente, y 287 (62,3%) con placebo presentaron eventos adversos, entre los cuales infarto agudo de miocardio y ataque isquémico transitorio dentro de un grupo de siete pacientes bajo tratamiento con galcanezumab 240 mg (Skljarevski et al., 2018). No hubo diferencias estadísticamente significativas en el cambio medio con respecto al valor inicial de la presión arterial sistólica/diastólica. Los 19 (8,6%), 11 (5,1%) y 2 (0,5%) pacientes de los grupos de galcanezumab 120 mg, galcanezumab 240 mg y placebo, respectivamente, mostraron anticuerpos antifármaco (ADA) emergentes del tratamiento. En el ensayo de fase III REGAIN que evalúa galcanezumab contra la migraña crónica se redujeron los MMD de 4,8 días con la dosis de 120 mg y de 4,6 días con la de 240 mg en comparación con los 2,7 del placebo (véase Yuan et al., 2017). Además, se demostró que el tratamiento con galcanezumab estaba dotado de una persistencia del efecto estadísticamente significativa (Forderreuther et al., 2018). Fremanezumab se investigó en el ensayo de fase III HALO para el tratamiento preventivo de la migraña (ClinicalTrials.gov NCT02638103). Redujo los MMD de la migraña episódica a las 12 semanas de 3,7 días con 225 mg mensuales durante 3 meses y de 3,4 días con 675 mg una vez en régimen de dosis trimestral en comparación con la disminución de 2,2 días del placebo (véase Yuan et al., 2017). La eficacia de erenumab en la prevención de la migraña episódica se estudió en el estudio de fase 3, aleatorizado, doble ciego y controlado con placebo ARISE (ClinicalTrials.gov NCT02483585). Los MMD se redujeron con 70 mg mensuales de erenumab subcutáneo de 2,9 días en comparación con 1,8 días de placebo (p < 0,001) y fue eficaz en los criterios de valoración secundarios de al menos una reducción del 50% en los MMD y el cambio en los días de tratamiento mensual con medicación específica para la migraña (MSMD) (Dodick et al., 2018). La proporción de pacientes que presentaron eventos adversos fue similar entre el grupo tratado con el mAb y el placebo; el 4,3% dio positivo en anticuerpos de unión a anti-erenumab hasta la semana 12, uno de los cuales dio positivo transitoriamente en anticuerpos neutralizantes, pero solo en la semana 4 (Dodick et al., 2018). También el ensayo clínico de fase III STRIVE (ClinicalTrials.gov NCT02456740) evaluó la eficacia de erenumab para la prevención de la migraña episódica. Erenumab se administró a 70 o 140 mg mensuales durante 6 meses (Goadsby et al., 2017b). La media basal de MMD fue de 8,3 y las dosis de 70 mg y 140 mg la redujeron de 3,2 y 3,7, respectivamente, en comparación con 1,8 días de placebo (con p < 0,001 para cada dosis frente a placebo) (Goadsby et al., 2017b). Asimismo, durante los últimos 3 meses de tratamiento, cada dosis de erenumab cumplió con los criterios de valoración secundarios de al menos un 50% de reducción respecto al inicio en el número medio de días de migraña al mes y de reducción respecto al inicio tanto en el Diario de Impacto de la Función Física de la Migraña (MPFID) actividades cotidianas (MPFID-EA) como en el deterioro físico (MPFID-PI) (Goadsby et al., 2017b). En los pacientes con anticuerpos anti-erenumab, solo uno del grupo tratado con 70 mg dio positivo en anticuerpos neutralizantes y el mAb fue en general bien tolerado en términos de niveles de creatinina, toxicidad hepática, recuento total de neutrófilos y función electrocardiográfica (Goadsby et al., 2017b). Según los autores, uno de los límites de este ensayo es que se excluyeron los pacientes que no habían mostrado respuesta terapéutica a más de dos clases de fármacos preventivos de la migraña (Goadsby et al., 2017b). Además, hay ensayos clínicos que investigan la eficacia de fremanezumab (NCT02945046 y NCT02964338) y galcanezumab (NCT 02397473 y NCT02438826) en la prevención de la cefalea en racimos (véase Israel et al., 2018), es decir, la cefalea primaria caracterizada por un dolor unilateral intenso en la zona periorbital acompañado de lagrimeo, enrojecimiento conjuntival y rinorrea (Vollesen et al., 2018). De hecho, se demostró que la infusión intravenosa continua a través de la bomba de infusión de 1,5 μg/min de CGRP durante 20 min (en 2 días separados por al menos 7 días) a pacientes con cefalea en racimos episódica (fase activa o de remisión) o crónica provocó ataques similares a los de los racimos en pacientes en fase activa o con cefalea en racimos crónica, pero no en fase de remisión (ClinicalTrials.gov NCT02466334) (Vollesen et al., 2018). Las principales ventajas PK de los mAbs están representadas por la larga vida media de eliminación, limitando así la necesidad de una dosis diaria y el aclaramiento por proteólisis. Debido a los efectos de los gepants en el hígado y a las propiedades vasodilatadoras del CGRP, los riesgos más temidos de la inhibición de la señalización del CGRP consisten en la hipotética hepatotoxicidad y el riesgo teórico cardiovascular (Yuan et al., 2017). La Federación Europea de Cefaleas (EHF) elaboró unas directrices sobre el uso de los mAbs anti-CGRP aplicando el método de Grading of Recommendation, Assessment, Development and Evaluation (GRADE) y, cuando no fue posible, basándose en la opinión de un panel de expertos (Sacco et al., 2019).
Relación farmacocinética (PK)/farmacodinámica (PD) de los mAbs antimigrañosos
El desarrollo de los mAbs ha representado un enfoque completamente nuevo para inhibir la vía del CGRP. La principal mejora de la PD conseguida utilizando mAbs en lugar de pequeñas moléculas es que es más fácil dirigirse al amplio sitio de unión del receptor CGRP al ligando (Taylor, 2018). Las principales ventajas PK de los mAbs están representadas por la larga vida media de eliminación sin necesidad de dosis diarias y el aclaramiento por proteólisis y los riesgos más temidos de la inhibición de la señalización del CGRP consisten en la hipotética hepatotoxicidad, debido a los efectos de los gepants sobre el hígado, y el riesgo teórico cardiovascular, por las propiedades vasodilatadoras del CGRP. Sin embargo, tras el recorrido de estos mAbs desde su producción hasta la diana, el primer obstáculo que encuentran estas moléculas es su administración debido a su escasa biodisponibilidad oral. Por ello, se requiere una vía de administración parenteral y, para favorecer la adherencia al tratamiento, es necesario que la vida media sea larga (Taylor, 2018). Las inmunoglobulinas (Ig)G1, 2 o 4 son las posibilidades (Wang et al., 2008; Taylor, 2018). Aparte del origen de la IgG, la eventual reactividad cruzada y las modificaciones individuales del catabolismo pueden afectar a la vida media (Bonilla, 2008; Taylor, 2018). La tecnología utilizada para producir mAbs se basa en el uso de hibridomas compuestos por células en continua división que producen clones determinados de un único tipo de anticuerpo, con nula o baja variabilidad (Taylor, 2018). Basándose en el origen de los aminoácidos que componen el mAb, es posible distinguir entre mAbs quiméricos (inmunización de roedores; mantenimiento de la región de unión al antígeno del fragmento Fab de roedores, pero introducción de la región cristalizable del fragmento Fc de humanos), humanizados (zumabs, con Regiones Determinantes de la Complementariedad, CDRs, de ratón, injertadas en regiones Fab de humanos) y humanos (introducción de toda la secuencia del gen del anticuerpo humano en el ratón que se humaniza, como por ejemplo el XenoMouse) (véase Taylor, 2018). Las CDR influyen en la adaptación a la diana. Entre los 4 mAbs antimigrañosos solo erenumab es humano, mientras que las CDR injertadas son de ratón para fremanezumab, de conejo para eptinezumab y probablemente de ratón para galcanezumab (véase Taylor, 2018). En concreto, el único mAb anti-receptor de CGRP es erenumab, que es una IgG2λ humana, y los otros tres mAbs dirigidos contra sitios de CGRP son: eptinezumab, una IgG1k humanizada de ingeniería genética; fremanezumab, una IgG2k humanizada; galcanezumab, una IgG4 humanizada (Edvinsson et al., 2018). Erenumab (Tmáx 3-14 días) requiere una administración subcutánea mensual, al igual que fremanezumab (Tmáx 3-20 días) y galcanezumab (Tmáx 7-14 días) (Taylor, 2018). Por el contrario, eptinezumab (Tmáx 4,8 h) se administra por vía intravenosa una vez cada 3 meses; se asocia más rápidamente y se disocia más lentamente que fremanezumab y galcanezumab. Como los mAbs son proteínas de gran tamaño, no pueden atravesar fácilmente la BBB. Algunos receptores de CGRP están fuera de la BBB, lo que permite la acción de los mAbs anti-CGRP (Edvinsson, 2018). Antes de unirse, el anticuerpo entra en las células endoteliales vasculares a través de la pinocitosis. Los grandes volúmenes de distribución aparente podrían depender del tejido y de la capacidad de unión relacionada del mAb (Lobo et al., 2004; Taylor, 2018). Erenumab es el enfoque más novedoso, ya que es el único que se dirige a una proteína de fusión de los dominios extracelulares del receptor humano acoplado a proteínas G CALCRL (necesario en los receptores para CGRP y adrenomedulina) y RAMP1, incluido el bolsillo de unión a CGRP (Edvinsson et al., 2018). Se ha demostrado que inhibe competitivamente la unión de -CGRP al receptor humano de CGRP en células de neuroblastoma humano (SK-N-MC) con un Ki de 0,02 ± 0,01 nM (Shi et al., 2016). Erenumab ejerció un antagonismo potente y completo de la acumulación de AMPc estimulada por CGRP con un IC50 de 2,3 ± 0,9 nM en ensayos funcionales realizados en SK-N-MC (Shi et al., 2016). Además, resultó 5000 veces más selectivo para el receptor CGRP, sin mostrar ningún efecto agonista/antagonista en otros receptores humanos de la familia de la calcitonina, incluidos los receptores de adrenomedulina, calcitonina y amilina, hasta la concentración más alta probada de 10 μM (Shi et al., 2016). El fremanezumab podría ejercer su efecto en diferentes vasos; de hecho, provoca una inhibición dependiente de la concentración de la vasodilatación inducida por el CGRP en arterias cerebrales, meníngeas y abdominales periféricas humanas precontraídas (Ohlsson et al., 2018). Además, el CGRP puede actuar también sobre las neuronas y las células gliales y sobre el glinfático (linfático), este último implicado en la expresión del aura (véase Messlinger, 2018). La probable ausencia de metabolismo por parte de las enzimas hepáticas podría evitar las interacciones farmacológicas. La eliminación se produce a través de la proteólisis renal de los aminoácidos. Aunque los ensayos clínicos informan de que estos anticuerpos son en general bien tolerados, aparte del destacado dolor en el lugar de la inyección, existe preocupación por su inmunogenicidad a través de la producción de ADA (Taylor, 2018). Durante un ensayo clínico doble ciego, aleatorizado y controlado con placebo (ClinicalTrials.gov NCT 01337596) en el que se evaluó el tratamiento con diferentes regímenes de dosis únicas y múltiples de galcanezumab, 11 de los pacientes tratados (26%) presentaron títulos bajos (1:10 – 1:80) de ADA emergentes del tratamiento (en 3 pacientes los anticuerpos preexistentes aumentaron de título), sin respuesta a la dosis y sin que se detectaran efectos sobre la FC y la EP (Monteith et al., 2017). El estudio de la inmunogenicidad es esencial porque la presencia de ADA puede acelerar la eliminación del fármaco o, lo que es peor, fomentar el daño en los órganos finales (Taylor, 2018). Las principales características de los mAbs antimigrañosos se resumen en la Tabla 1.

Tabla 1. Características principales de fremanezumab, eptinezumab, galcanezumab y erenumab.
Conclusión
La migraña es una condición dolorosa neurovascular incapacitante y debilitante que representa más del 90% de los casos de cefalea recurrente y hacia la cual la tendencia puede ser hereditaria (MacGregor, 2017). El divalproex sódico, el valproato sódico, el topiramato, el metoprolol, el propranolol y el timolol han demostrado una fuerte evidencia, de nivel A, para la prevención de la migraña (American Academy of Neurology y American Headache Society, 2015). Sin embargo, todos los tratamientos preventivos orales clásicos, incluidos los antidepresivos tricíclicos, los betabloqueantes, los antagonistas 5-HT2, los cornezuelos y los fármacos antiepilépticos, no se desarrollaron para la migraña y proporcionan una reducción del 50% en el número de días mensuales de dolor migrañoso sólo hasta el 45% de los migrañosos (D’Amico y Tepper, 2008), también debido a la baja adherencia por su escasa tolerabilidad. La persistencia y la interrupción de la medicación se examinaron en un análisis retrospectivo de reclamaciones en los Estados Unidos (Hepp et al., 2017) y los resultados sugieren una baja persistencia al fármaco inicial utilizado y una alta cantidad de interrupciones a los 6 meses, independientemente de la clase de fármaco. Debido al papel fundamental del CGRP en el mantenimiento de la neuroinflamación y la sensibilización central en la vía que va desde el ganglio del trigémino y el tronco cerebral hasta las regiones superiores implicadas en la fisiopatología de la migraña, se han desarrollado nuevos mAbs contra el CGRP y su receptor. Las primeras moléculas pequeñas antagonistas del CGRP demostraron inducir toxicidad hepática, pero los mAbs no produjeron metabolitos tóxicos ni reacciones secundarias cardiovasculares debido a la inhibición de la vasodilatación (véase Deen et al., 2017). Tampoco se destacaron los efectos secundarios centrales. Los posibles efectos a largo plazo del bloqueo del CGRP aún deben estudiarse pero, una ventaja fundamental de estos anticuerpos se deriva de su larga vida media que permite inyecciones mensuales o menos frecuentes, lo que puede mejorar notablemente la adherencia al tratamiento y su eficacia posterior (Deen et al., 2017). Por lo tanto, los mAbs anti-CGRP podrían representar herramientas eficaces en el arsenal terapéutico contra la migraña que no responde; sin embargo, es obligatorio un seguimiento profundo de la eficacia y la seguridad (es decir, la producción de metabolitos tóxicos, la inmunogenicidad con ADA, los anticuerpos neutralizantes y la reactividad cruzada de los tejidos y los efectos secundarios) (Taylor, 2018). De hecho, las pruebas de productos biotecnológicos más antiguos muestran que las terapias con mAbs contra el factor de necrosis tumoral α (TNFα) pueden estar sujetas a un fracaso secundario (en contraste con los no respondedores primarios) de la respuesta terapéutica inicial porque estos fármacos inducen la producción de anticuerpos que pueden degradar el mAb pero también pueden neutralizar su acción antes de unirse a la diana (véase Prado et al., 2017). La inmunogenicidad puede verse influida por la glicosilación, el tipo de mAb, el número de epítopos y las impurezas en la formulación (véase Prado et al., 2017). Además, varios efectos secundarios graves aparentemente inexplicables están asociados a la inmunogenicidad de los anti-TNFα. Se han destacado las reacciones de hipersensibilidad local y sistémica, la inmunodeficiencia con mayor susceptibilidad a las infecciones y la formación de inmunocomplejos que pueden llevar incluso a la muerte (véase Prado et al., 2017). Por lo tanto, el uso de diagnósticos terapéuticos (teranósticos) puede mejorar el conocimiento y el correcto manejo de estos dispositivos farmacológicos (Bendtzen, 2013; Prado et al., 2017).
Contribuciones de los autores
MTC, LAM, PT y GB concibieron el estudio. DS recogió los resultados del ensayo, analizó la literatura y redactó el manuscrito. AA, LR, y MN participó en el estudio de la literatura. Todos los autores leyeron y aprobaron el manuscrito final.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Academia Americana de Neurología y Sociedad Americana de Cefaleas (2015). Apéndice a: resumen de la guía basada en la evidencia para clínicos, actualización: tratamiento farmacológico para la prevención de la migraña episódica en adultos. Continuum 21, 1165-1166. doi: 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | CrossRef Full Text | Google Scholar
Bendtzen, K. (2013). Medicina personalizada: la teranóstica (diagnóstico terapéutico) esencial para el uso racional de los antagonistas del factor de necrosis tumoral alfa. Discov. Med. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). Farmacocinética de la inmunoglobulina administrada por vía intravenosa o subcutánea. Immunol. Allergy Clin. North Am. 28, 803-819. doi: 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Colaboradores, G. B. D. H. (2018). Carga mundial, regional y nacional de la migraña y la cefalea tensional, 1990-2016: un análisis sistemático para el estudio de la carga mundial de la enfermedad 2016. Lancet Neurol. 17, 954-976. doi: 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., y Tepper, S. J. (2008). Profilaxis de la migraña: principios generales y aceptación del paciente. Neuropsychiatr. Dis. Treat. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Rubio-Beltran, E., et al. (2017). Bloqueo del CGRP en pacientes con migraña: una revisión de los pros y los contras. J. Headache Pain 18:96. doi: 10.1186/s10194-017-0807-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V., et al. (2018). ARISE: un ensayo aleatorio de fase 3 de erenumab para la migraña episódica. Cephalalgia 38, 1026-1037. doi: 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D., y Lance, J. W. (1983). Cambios vasculares extracraneales y el origen del dolor en la cefalea migrañosa. Ann. Neurol. 13, 32-37. doi: 10.1002/ana.410130108
PubMed Abstract | CrossRef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J. Y., Ossipov, M. H., Dodick, D. W., y Porreca, F. (2014). Targeting TRP channels for novel migraine therapeutics. ACS Chem. Neurosci. 5, 1085-1096. doi: 10.1021/cn500083e
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2015). Antagonistas del receptor CGRP y anticuerpos contra el CGRP y su receptor en el tratamiento de la migraña. Br. J. Clin. Pharmacol. 80, 193-199. doi: 10.1111/bcp.12618
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2018). La vía CGRP en la migraña como un objetivo viable para las terapias. Headache 58(Suppl. 1), 33-47. doi: 10.1111/head.13305
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L., Haanes, K. A., Warfvinge, K., y Krause, D. N. (2018). El CGRP como objetivo de las nuevas terapias contra la migraña: traslación exitosa del banco a la clínica. Nat. Rev. Neurol. 14, 338-350. doi: 10.1038/s41582-018-0003-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Eftekhari, S., Warfvinge, K., Blixt, F. W., y Edvinsson, L. (2013). Diferenciación de las fibras nerviosas que almacenan CGRP y receptores CGRP en el sistema trigeminovascular periférico. J. Pain 14, 1289-1303. doi: 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, M. S., Cheng, X., Jeffry, J. A., Disney, K. E., y Premkumar, L. S. (2012). Sumatriptan inhibe los canales TRPV1 en las neuronas del trigémino. Headache 52, 773-784. doi: 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B., y Goadsby, P. J. (2001). Oral triptans (serotonin 5-HT(1B/1D) agonists) in acute migraine treatment: a meta-analysis of 53 trials. Lancet 358, 1668-1675. doi: 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K., and Lainez, M. J. A. (2018). Los efectos preventivos de galcanezumab en pacientes adultos con migraña episódica o crónica son persistentes: datos de los estudios de fase 3, aleatorizados, doble ciego y controlados con placebo EVOLVE-1, EVOLVE-2 y REGAIN. J. Headache Pain 19:121. doi: 10.1186/s10194-018-0951-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F., y Martelletti, P. (2017). El receptor del péptido relacionado con el gen de la calcitonina como una nueva diana para el tratamiento de las personas con migraña episódica: evidencia actual y perfil de seguridad de erenumab. J. Pain Res. 10, 2751-2760. doi: 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., y Martelletti, P. (2015). Fármacos emergentes para el tratamiento de la migraña. Expert Opin. Emerg. Drugs 20, 137-147. doi: 10.1517/14728214.2015.999040
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Edvinsson, L., y Ekman, R. (1990). Vasoactive peptide release in the extracerebral circulation of humans during migraine headache. Ann. Neurol. 28, 183-187. doi: 10.1002/ana.410280213
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Holland, P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C., y Akerman, S. (2017a). Fisiopatología de la migraña: un trastorno del procesamiento sensorial. Physiol. Rev. 97, 553-622. doi: 10.1152/physrev.00034.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J. H., Zhang, F., et al. (2017b). Un ensayo controlado de erenumab para la migraña episódica. N. Engl. J. Med. 377, 2123-2132. doi: 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P., et al. (2017). Persistencia y patrones de cambio de medicamentos profilácticos orales para la migraña entre los pacientes con migraña crónica: un análisis retrospectivo de reclamaciones. Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J., et al. (2012). Estudio aleatorio y controlado de telcagepant en pacientes con migraña y enfermedad arterial coronaria. Headache 52, 224-235. doi: 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L., y Reuter, U. (2018). Anticuerpos monoclonales CGRP para el tratamiento preventivo de la migraña. Curr. Pain Headache Rep. 22:38. doi: 10.1007/s11916-018-0686-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M., y Martelletti, P. (2018). Fármacos emergentes para el tratamiento de la migraña: una actualización. Expert Opin. Emerg. Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B., y Olesen, J. (2002). CGRP may play a causative role in migraine. Cephalalgia 22, 54-61. doi: 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E. D., Hansen, R. J., y Balthasar, J. P. (2004). Farmacocinética y farmacodinámica de anticuerpos. J. Pharm. Sci. 93, 2645-2668. doi: 10.1002/jps.20178
PubMed Abstract | CrossRef Full Text | Google Scholar
MacGregor, E. A. (2017). Migraña. Ann. Intern. Med. 166, ITC49-ITC64. doi: 10.7326/AITC201704040
PubMed Abstract | CrossRef Full Text | Google Scholar
Martelletti, P. (2017). La aplicación de los anticuerpos monoclonales CGRP(r) en el espectro de la migraña: necesidades y prioridades. BioDrugs 31, 483-485. doi: 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). La gran inundación de CGRP: fuentes, sumideros y sitios de señalización en el sistema trigeminovascular. J. Headache Pain 19:22. doi: 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., Vandermeulen, C., Van Hecken, A., Raddad, E., Scherer, J. C., et al. (2017). Seguridad, tolerabilidad, farmacocinética y farmacodinámica del anticuerpo monoclonal de unión a CGRP LY2951742 (Galcanezumab) en voluntarios sanos. Front. Pharmacol. 8:740. doi: 10.3389/fphar.2017.00740
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J., y Edvinsson, L. (2018). Fremanezumab bloquea la dilatación inducida por CGRP en las arterias cerebrales, meníngeas medias y abdominales humanas. J. Headache Pain 19:66. doi: 10.1186/s10194-018-0905-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Prado, M. S., Bendtzen, K., y Andrade, L. E. C. (2017). Fármacos biológicos anti-TNF: inmunogenicidad subyacente al fracaso del tratamiento y eventos adversos. Expert Opin. Drug Metab. Toxicol. 13, 985-995. doi: 10.1080/17425255.2017.1360280
PubMed Abstract | CrossRef Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X., y Brain, S. D. (2014). Péptido relacionado con el gen de la calcitonina: fisiología y fisiopatología. Physiol. Rev. 94, 1099-1142. doi: 10.1152/physrev.00034.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U., Terwindt, G., Mitsikostas, D. D., et al. (2019). Guía de la Federación Europea de Cefaleas sobre el uso de anticuerpos monoclonales que actúan sobre el péptido relacionado con el gen de la calcitonina o su receptor para la prevención de la migraña. J. Headache Pain 20:6. doi: 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., Dodick, D., Silberstein, S., et al. (2018). Resultados primarios del ensayo PROMISE-1 (prevención de la migraña a través de la seguridad y la eficacia de eptinezumab intravenoso-1): un estudio de fase 3, aleatorizado, doble ciego y controlado con placebo para evaluar la eficacia y la seguridad de eptinezumab para la prevención de las migrañas episódicas frecuentes (S20.001). Neurology 90(15 Suppl.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al. (2016). Caracterización farmacológica de AMG 334, un anticuerpo monoclonal humano potente y selectivo contra el receptor del péptido relacionado con el gen de la calcitonina. J. Pharmacol. Exp. Ther. 356, 223-231. doi: 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K., y Yang, J. Y. (2018). Eficacia y seguridad de galcanezumab para la prevención de la migraña episódica: resultados del ensayo clínico controlado aleatorio de fase 3 EVOLVE-2. Cephalalgia 38, 1442-1454. doi: 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J., y Conley, R. R. (2018). Evaluación de galcanezumab para la prevención de la migraña episódica: el ensayo clínico aleatorio EVOLVE-1. JAMA Neurol. 75, 1080-1088. doi: 10.1001/jamaneurol.2018.1212
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R., y Katsarava, Z. (2018). La migraña es la primera causa de discapacidad en menores de 50 años: ¿tomarán nota ahora los políticos sanitarios? J. Headache Pain 19:17. doi: 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R. (2018). CGRP, amilina, inmunología y medicina del dolor de cabeza. Headache 59, 131-150. doi: 10.1111/head.13432
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al. (2017). Biomarcadores de migraña en el líquido cefalorraquídeo: una revisión sistemática y un metaanálisis. Cephalalgia 37, 49-63. doi: 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A. L. H., Snoer, A., Beske, R. P., Guo, S., Hoffmann, J., Jensen, R. H., et al. (2018). Efecto de la infusión de péptido relacionado con el gen de la calcitonina en los ataques de cefalea en racimos: un ensayo clínico aleatorizado. JAMA Neurol. 75, 1187-1197. doi: 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, C. S., Conner, A. C., Poyner, D. R., y Hay, D. L. (2010). Regulation of signal transduction by calcitonin gene-related peptide receptors. Trends Pharmacol. Sci. 31, 476-483. doi: 10.1016/j.tips.2010.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, E. Q., and Balthasar, J. P. (2008). Farmacocinética y farmacodinámica de los anticuerpos monoclonales. Clin. Pharmacol. Ther. 84, 548-558. doi: 10.1038/clpt.2008.170
PubMed Abstract | CrossRef Full Text | Google Scholar
Xanthos, D. N., and Sandkuhler, J. (2014). Neuroinflamación neurogénica: reacciones inflamatorias del SNC en respuesta a la actividad neuronal. Nat. Rev. Neurosci. 15, 43-53. doi: 10.1038/nrn3617
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, H., Lauritsen, C. G., Kaiser, E. A., y Silberstein, S. D. (2017). Anticuerpos monoclonales CGRP para la migraña: fundamentos y avances. BioDrugs 31, 487-501. doi: 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar