Las complicaciones mecánicas del infarto agudo de miocardio (IAM) son la comunicación interventricular (CIV), la rotura o disfunción del músculo papilar, la rotura de la pared libre cardíaca, el aneurisma ventricular, la obstrucción dinámica del tracto de salida (TS) del ventrículo izquierdo (VI) y la insuficiencia del ventrículo derecho (VD). Todas estas condiciones pueden conducir potencialmente a un fallo del VI con shock cardiogénico.
Un conocimiento profundo de las complicaciones mecánicas del IAM y de sus factores de riesgo puede ayudar a los clínicos a realizar un diagnóstico temprano. Para que los resultados de los pacientes sean favorables, se requiere un diagnóstico rápido con un tratamiento médico adecuado y una intervención quirúrgica oportuna. Entre los factores importantes de mortalidad intrahospitalaria por complicaciones mecánicas del IAM se encuentran la edad avanzada, el shock cardiogénico y la insuficiencia cardiorrespiratoria.
Ruptura de la pared libre ventricular
La RVF es la complicación más grave del IAM. La rotura de la pared libre del ventrículo suele estar asociada a grandes infartos transmurales y a la expansión previa del infarto. Es la causa más frecuente de muerte, sólo superada por el fallo del VI, y es responsable del 15-30% de las muertes asociadas al IAM. Incontrovertiblemente, la más catastrófica de las complicaciones mecánicas, la RVF conduce al hemopericardio agudo y a la muerte por taponamiento cardíaco.
La incidencia global de la RVF oscila entre el 0,8 y el 6,2%. La incidencia de esta complicación ha disminuido a lo largo de los años con un mejor control de la presión arterial sistólica de 24 horas; un mayor uso de la terapia de reperfusión, de los betabloqueantes y de los inhibidores de la ECA; y un menor uso de la heparina.
Los datos del Registro Nacional de Infarto de Miocardio (NRMI) mostraron una incidencia elevada de mortalidad intrahospitalaria entre los pacientes que recibieron terapia trombolítica (12,1%) que entre los que no la recibieron (6,1%). En el ensayo Thrombolysis in Myocardial Infarction Phase II (TIMI II), el 16% de los pacientes murieron por rotura cardíaca en las 18 horas siguientes al tratamiento. Los pacientes sometidos a angioplastia coronaria transluminal percutánea (ACTP) tuvieron una incidencia de rotura de la pared libre inferior a la de los pacientes que recibieron tratamiento trombolítico.
Los factores de riesgo de RVF son la edad avanzada superior a 70 años, el sexo femenino, la ausencia de IM anteriores, las ondas Q en el ECG, la hipertensión durante la fase inicial del IAMCEST, el uso de corticosteroides o AINE y el tratamiento fibrinolítico más de 14 horas después del inicio del IAMCEST. Los pacientes con antecedentes de angina de pecho, IAM previo, enfermedad coronaria multivaso e insuficiencia cardiaca crónica son menos propensos que los demás a desarrollar FVR del VI porque desarrollan colaterales y precondicionamiento isquémico.
Presentación clínica de la FVR
Las FVR son dramáticas; se presentan de forma aguda u ocasionalmente subaguda como pseudoaneurismas; y con mayor frecuencia afectan a la pared anterior o lateral del VI. La mayoría de las VFWR se producen en la primera semana después del IAM.
Becker et al clasificaron los siguientes 3 tipos de RVF :
-
Tipo I – un desgarro abrupto en forma de hendidura que se asocia frecuentemente con infartos anteriores y que se produce de forma precoz (dentro de las 24 h)
-
Tipo II – una erosión del miocardio infartado en la frontera entre el miocardio infartado y el viable
-
Tipo III – una formación temprana de aneurisma correlacionada con infartos más antiguos y severamente expandidos
El tipo III suele ocurrir más tarde que las roturas de tipo I o II. El tratamiento trombolítico acelera la aparición de la rotura cardíaca en los infartos de tipo I y II de Becker. En los infartos severamente expandidos (tipo III), la terapia trombolítica disminuye la incidencia de ruptura cardíaca.
Un pseudoaneurisma se forma cuando el pericardio y el hematoma adyacentes sellan una ruptura o perforación miocárdica. La pared de un pseudoaneurisma se visualiza con mayor frecuencia como una bolsa aneurismática que se comunica con la cavidad del VI por medio de un cuello estrecho. Esta pared está compuesta por pericardio y trombo organizado y/o hematoma. Está desprovista de elementos miocárdicos, mientras que un aneurisma verdadero tiene todos los elementos de la pared miocárdica original y una base relativamente amplia. El pseudoaneurisma puede variar de tamaño y presenta un alto riesgo de rotura.
Las presentaciones clínicas de la FVR varían en función de la agudeza, la localización y el tamaño de la rotura. Los pacientes con RVF aguda presentan dolor torácico intenso, disociación electromecánica abrupta o asistolia, colapso hemodinámico y posiblemente la muerte. En aproximadamente un tercio de los pacientes, el curso es subagudo y presentan síntomas como síncope, hipotensión, shock, arritmia y dolor torácico prolongado y recurrente.
Diagnóstico de la RVF
El diagnóstico temprano de la RVF y la intervención son fundamentales para la supervivencia del paciente. Se requiere un alto índice de sospecha cuando los pacientes con IAM se presentan con dolor torácico intenso, shock o arritmias y desarrollo abrupto de disociación electromecánica. Los signos ECG de inminente RVF tienen una especificidad limitada, pero incluyen taquicardia sinusal, defecto de conducción intraventricular y elevación persistente o recurrente del segmento ST.
La ecocardiografía es la herramienta diagnóstica de elección. El hallazgo diagnóstico clave es un derrame pericárdico de moderado a grande con signos clínicos y ecocardiográficos de taponamiento pericárdico inminente. En los pacientes con taponamiento cardíaco y disociación electromecánica, el derrame pericárdico de moderado a grave aumenta el riesgo de mortalidad. Aquellos pacientes sin taponamiento cardíaco inicial, aunque tienen una tasa de mortalidad más baja, deben ser seguidos de todos modos, ya que aún puede producirse una ruptura tardía. La ausencia de derrame pericárdico en la ecocardiografía tiene un alto valor predictivo negativo. Si la capacidad de obtener ecocardiogramas transtorácicos es limitada en los pacientes que reciben ventilación mecánica, la ecocardiografía transesofágica puede ayudar a confirmar la FVR.
La RMN proporciona una calidad de imagen superior y permite identificar el lugar y la anatomía de un pseudoaneurisma ventricular (es decir, la rotura del VI retenida por el pericardio con un coágulo incluido). Sin embargo, la RM es de uso limitado en el contexto agudo debido al tiempo que conlleva y a la imposibilidad de transportar las unidades de imagen.
Tratamiento de la FVR
La estrategia de prevención más importante es la terapia de reperfusión temprana, siendo la intervención coronaria percutánea (ICP) la modalidad preferida. El tratamiento fibrinolítico se asocia con una disminución general del riesgo de RVF; sin embargo, su uso más de 14 horas después del inicio del IAMCEST puede aumentar el riesgo de rotura temprana.
El tratamiento estándar para la RVF es la reparación quirúrgica de emergencia una vez que se ha conseguido la estabilidad hemodinámica. Los pacientes pueden necesitar primero líquidos intravenosos, agentes inotrópicos y una pericardiocentesis de emergencia.
Pifarré y asociados recomendaron la implantación de un balón de contrapulsación intraaórtico para disminuir la poscarga sistólica y mejorar la perfusión miocárdica diastólica.
Se han aplicado varias técnicas quirúrgicas, como la infarctectomía, la adhesión con parches de pegamento biológico de fibra de poliéster de tereftalato de polietileno (Dacron; DuPont, Wilmington, DE) o resina de fluoropolímero de politetrafluoroetileno (Teflon; DuPont); y el uso de suturas pledgeted sin infarctectomía.
La tasa de mortalidad es significativamente alta y depende en gran medida del estado hemodinámico preoperatorio del paciente. El diagnóstico precoz, la rápida instauración de las medidas descritas anteriormente para lograr la estabilidad hemodinámica y la pronta reparación quirúrgica pueden mejorar las tasas de supervivencia. Un seguimiento del ensayo aleatorizado Acorn demostró una mejora a largo plazo de la estructura y la función del ventrículo izquierdo tras la cirugía de la válvula mitral durante 5 años. Estos datos aportan pruebas que apoyan la reparación de la válvula mitral en combinación con el dispositivo Acorn CorCap para pacientes con insuficiencia cardíaca no isquémica con disfunción ventricular izquierda grave que han sido optimizados médicamente pero siguen siendo sintomáticos con regurgitación mitral significativa.
Ruptura del tabique ventricular
La RVS es una complicación infrecuente pero potencialmente mortal del IAM. A pesar del tratamiento médico y quirúrgico óptimo, los pacientes con RVS tienen una alta tasa de mortalidad intrahospitalaria. En la época anterior a los trombolíticos, los RVS se producían en el 1-3% de los individuos con IAM. La incidencia disminuyó con el tratamiento trombolítico (hasta el 0,2-0,34%) debido a las mejoras en la reperfusión y el rescate del miocardio. La distribución bimodal de la RVS se caracteriza por una alta incidencia en las primeras 24 horas, con otro pico en los días 3-5 y raramente más de 2 semanas después del IAM.
En los pacientes que reciben trombolíticos, la mediana de tiempo desde el inicio de los síntomas del IAM hasta la rotura septal fue de 1 día en el ensayo Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries (GUSTO-I) y de 16 horas en el ensayo Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock? (SHOCK).
Los factores de riesgo de rotura septal incluyen la edad avanzada (>65 años), el sexo femenino, la enfermedad de un solo vaso, el IM extenso y la mala circulación colateral septal. Antes de la llegada de los trombolíticos, la hipertensión y la ausencia de antecedentes de angina eran factores de riesgo de RVS. El tamaño extenso del infarto y la afectación del VD son otros factores de riesgo conocidos para la rotura septal.
En pacientes con IAM sin reperfusión, la necrosis de la coagulación se desarrolla en los 3-5 días siguientes al infarto. Los neutrófilos migran a la zona necrótica y sufren apoptosis, liberan enzimas líticas y aceleran la desintegración del miocardio necrótico. Algunos pacientes presentan infartos con grandes hematomas intramurales, que se disecan en el tejido y provocan una rotura septal temprana. El tamaño de la rotura septal oscila entre unos pocos milímetros y varios centímetros.
La RVS se clasifica como simple o compleja dependiendo de su longitud, curso y localización. En la rotura septal simple, la perforación se encuentra al mismo nivel en ambos lados del tabique y existe una comunicación directa a través del tabique. Una rotura septal compleja se caracteriza por una extensa hemorragia con tractos irregulares y serpiginosos en el tejido necrótico.
Las roturas septales son más comunes en pacientes con grandes IM anteriores debido a la oclusión de la arteria LAD que causa extensos infartos septales. Estos infartos se asocian con elevaciones del segmento ST y ondas Q en las derivaciones inferiores (II, III, aVF), por lo que estos cambios en el ECG se observan con mayor frecuencia en las rupturas septales. Estas roturas son generalmente apicales y simples.
Las roturas septales en pacientes con IM inferior ocurren con relativa poca frecuencia. Estas roturas afectan al tabique inferoposterior basal y suelen ser complejas.
Presentación clínica de la RVS
Los síntomas de la RVS que complican el IAM incluyen dolor torácico, dificultad respiratoria, hipotensión, insuficiencia biventricular y shock en un plazo de horas a días. Los pacientes a menudo presentan un soplo holosistólico nuevo, fuerte y duro. Este soplo es más fuerte a lo largo del borde inferior del esternón izquierdo y se asocia a un thrill sistólico paraesternal palpable. Los galopes S3 del VD y el VI son comunes.
En pacientes con shock cardiogénico que complican la rotura septal, el soplo y el thrill pueden ser difíciles de identificar. Por el contrario, los pacientes con IM aguda suelen presentar un soplo sistólico suave en el ápice sin thrill.
Diagnóstico de la RVS
La ecocardiografía con Doppler color es la herramienta diagnóstica de elección para identificar una RVS. (Su sensibilidad y especificidad han llegado a ser del 100%. Además, puede utilizarse para lo siguiente:
-
Definir el lugar y el tamaño de la rotura septal
-
Evaluar el VI y el VD función
-
Estimar la presión sistólica del VD
-
Cuantificar el shunt izquierda-a derecha
Suele ser necesario un cateterismo cardíaco para confirmar el diagnóstico, cuantificar el grado de derivación izquierda-derecha, diferenciar la RVS de otras afecciones (por ejemplo, la regurgitación mitral) y visualizar las arterias coronarias.
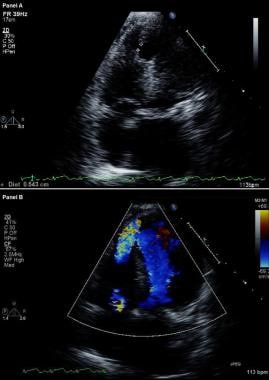 Complicaciones del infarto de miocardio. Ecocardiograma bidimensional modificado (arriba) e imagen Doppler color (abajo). Las vistas apicales de cuatro cámaras muestran una brecha en el tabique interventricular y una comunicación libre entre los ventrículos a través de una gran comunicación interventricular del tabique apical en un paciente que ha sufrido recientemente un infarto de miocardio anterior.
Complicaciones del infarto de miocardio. Ecocardiograma bidimensional modificado (arriba) e imagen Doppler color (abajo). Las vistas apicales de cuatro cámaras muestran una brecha en el tabique interventricular y una comunicación libre entre los ventrículos a través de una gran comunicación interventricular del tabique apical en un paciente que ha sufrido recientemente un infarto de miocardio anterior. En los pacientes con RVS, el cateterismo cardíaco derecho muestra un aumento de la saturación de oxígeno desde la aurícula derecha hasta el VD; en cambio, no se produce ningún aumento de la saturación de oxígeno en los pacientes con RM. La presencia de grandes ondas V en el trazado de cuña capilar pulmonar apoya el diagnóstico de RM aguda grave.
La ventriculografía izquierda también puede utilizarse para identificar el lugar de la rotura ventricular (véase Cateterismo cardíaco ). Sin embargo, este estudio suele ser innecesario después de realizar un examen ecocardiográfico y Doppler de buena calidad.
Tratamiento de la RVS
La clave del tratamiento de la RVS es el diagnóstico rápido y un enfoque agresivo de estabilización hemodinámica, angiografía y cirugía. El enfoque óptimo incluye la estabilización hemodinámica con la administración de oxígeno y el soporte mecánico con el uso de un balón de contrapulsación intraaórtico, así como la administración de vasodilatadores (para reducir la poscarga y, por tanto, la presión del VI y el shunt izquierda-derecha), diuréticos y agentes inotrópicos.
Se necesita un cateterismo cardíaco para definir la anatomía coronaria; a continuación, se realiza una reparación quirúrgica urgente.
En un estudio de 52 pacientes consecutivos con rotura del tabique ventricular después de un infarto que se reparó quirúrgicamente, los investigadores descubrieron que la tasa de mortalidad a los 30 días era del 36% (n = 19). La mayoría de los pacientes que sobrevivieron menos de 30 días tenían un estado de shock preoperatorio. Los investigadores concluyen que para los pacientes con rotura del tabique ventricular es necesario mejorar el estado de shock preoperatorio y realizar una revascularización coronaria agresiva.
El tratamiento médico está destinado únicamente a la estabilización temporal antes de la cirugía, ya que el estado de la mayoría de los pacientes se deteriora rápidamente y mueren en ausencia de intervención quirúrgica. En el ensayo GUSTO-I, la tasa de mortalidad a 30 días fue menor en los pacientes con RVS sometidos a reparación quirúrgica que en los pacientes tratados médicamente (47% frente a 94%), al igual que la tasa de mortalidad a 1 año (53% frente a 97%). Lemery et al informaron de una tasa de supervivencia a los 30 días del 24% en los pacientes tratados médicamente frente al 47% en los tratados quirúrgicamente.
Las directrices del American College of Cardiology/American Heart Association (ACC/AHA) para el tratamiento de los pacientes con rotura septal que complican un IAM destacan la intervención quirúrgica urgente, independientemente de su estado clínico. El tratamiento quirúrgico de la rotura septal incluye los siguientes elementos:
-
Establecimiento rápido de un bypass cardiopulmonar hipotérmico
-
Un abordaje de la rotura septal a través de la zona del infarto y la escisión de todos los márgenes necróticos y friables del septo y las paredes ventriculares para evitar la hemorragia postoperatoria, el defecto septal residual, o ambos
-
La reconstrucción del tabique y las paredes ventriculares mediante el uso de material protésico y la preservación de la configuración geométrica de los ventrículos y la función cardíaca
El cierre percutáneo de la rotura septal es un enfoque relativamente nuevo, que se utiliza en pacientes seleccionados como alternativa a la reparación quirúrgica o para la estabilización aguda de pacientes en estado crítico. Sin embargo, el cierre percutáneo no está disponible actualmente en muchas instituciones, y no se dispone de datos de resultados a largo plazo.
Varios estudios no lograron mostrar una relación entre la mortalidad perioperatoria y la revascularización coronaria concomitante (injerto de derivación arterial coronaria). Los pacientes con shock cardiogénico debido a una rotura septal son los que presentan peores resultados. En el ensayo SHOCK, la tasa de mortalidad intrahospitalaria fue mayor en los pacientes con shock cardiogénico por rotura septal (87,3%) que en los pacientes con shock cardiogénico por todas las demás causas (59,2% con insuficiencia VI pura y 55,1% con IM aguda).
En los pacientes que sobreviven a la reparación quirúrgica, se informa de que la tasa de defecto septal recurrente o residual es de aproximadamente el 28%, y la tasa de mortalidad asociada es elevada.
La repetición de la intervención quirúrgica está indicada en los pacientes que presentan insuficiencia cardíaca clínica o una fracción pulmonar-sistémica superior a 2.
Regurgitación mitral aguda
La RM es una complicación común del IAM que resulta del remodelado local y global del VI y que es un predictor independiente de insuficiencia cardíaca y muerte. La RM suele aparecer entre 7 y 10 días después de un IAM, aunque este inicio puede variar según el mecanismo de la RM. La rotura del músculo papilar que da lugar a la IM se produce entre 1 y 14 días (mediana, 1 día).
La IM de leve a moderada suele ser clínicamente silenciosa y se detecta en la ecocardiografía Doppler realizada durante la fase inicial del IAM. En estos casos, la RM rara vez causa compromiso hemodinámico.
El rastreo de manchas y la ecocardiografía tridimensional demostraron ser herramientas de imagen importantes para evaluar el remodelado inverso del VI después de la cirugía de regurgitación de la válvula mitral degenerativa. Los sutiles cambios regionales preoperatorios en la función diastólica de la pared septal y lateral pudieron ser identificados preoperatoriamente, lo que ayudó a optimizar el momento de la derivación y a reconocer los posibles culpables como indicadores de recurrencia de la enfermedad tras la reparación mitral.
La IM aguda grave que resulta de la rotura de los músculos papilares o de las cuerdas tendinosas da lugar a un deterioro hemodinámico brusco con shock cardiogénico. El diagnóstico rápido, la estabilización hemodinámica y la intervención quirúrgica inmediata son necesarios porque la IM aguda grave se asocia a una alta tasa de mortalidad.
La incidencia notificada de la IM puede variar debido a varios factores, como los métodos de diagnóstico utilizados, la presencia o ausencia de insuficiencia cardíaca, el grado de IM notificado, el tipo de tratamiento administrado y el tiempo transcurrido desde el inicio del infarto hasta la prueba.
Durante el ensayo GUSTO-I, la incidencia de la IM en los pacientes que recibieron tratamiento trombolítico fue del 1,73%. En el ensayo SHOCK, que incluyó a pacientes con IM que presentaban un shock cardiogénico, se observó una incidencia del 39,1% de IM de moderada a grave. Kinn et al informaron de que la reperfusión con angioplastia dio lugar a una disminución del 82% en la tasa de IM aguda, en comparación con el tratamiento trombolítico (0,31% frente a 1,73%).
Los factores de riesgo para la IM son la edad avanzada, el sexo femenino, el infarto grande, el IAM previo, la isquemia recurrente, la enfermedad coronaria multivaso y la insuficiencia cardíaca.
Varios mecanismos pueden causar la IM después del IAM. La ruptura del músculo papilar es el mecanismo más comúnmente reportado.
Esta ruptura ocurre en el 1% de los pacientes con IAM y frecuentemente involucra al músculo papilar posteromedial en lugar del músculo papilar anterolateral, ya que el primero tiene un solo suministro de sangre frente al doble suministro del segundo. La rotura del músculo papilar puede dar lugar a la flacidez o al prolapso de las valvas, lo que da lugar a una IM grave. La disfunción del músculo papilar debida a la cicatrización o a la isquemia recurrente también puede dar lugar a una IM en las fases subaguda y crónica después del IM; esta condición puede resolverse espontáneamente.
Los infartos posteriores grandes producen una IM aguda debido a la dilatación anular asimétrica y a la alteración de la función y la geometría del músculo papilar.
Presentación clínica de la IM
Los pacientes con una IM funcional leve o moderada suelen ser asintomáticos. La gravedad de los síntomas varía según la función ventricular. Las características clínicas de la IM aguda grave incluyen dificultad respiratoria, fatiga, un nuevo soplo holosistólico apical, edema pulmonar repentino y shock.
El nuevo soplo sistólico puede ser sólo sistólico temprano o medio, no holosistólico. Puede ser suave o incluso estar ausente debido al aumento brusco de la presión auricular izquierda, que disminuye el gradiente de presión entre la aurícula izquierda y el VI, en comparación con la RM crónica. El soplo se escucha mejor en el ápice que en el borde inferior del esternón izquierdo, y no es frecuente que se asocie a un thrill. Se esperan galopes S3 y S4.
Diagnóstico de la RM
El clínico no puede confiar en un nuevo soplo holosistólico para diagnosticar la RM o evaluar su gravedad debido al estado hemodinámico variable. En un paciente con IAM que presenta un nuevo soplo sistólico apical, edema pulmonar agudo y shock cardiogénico, un alto índice de sospecha clínica de IM grave es la clave para el diagnóstico.
La radiografía de tórax puede mostrar evidencia de edema pulmonar en el contexto agudo sin agrandamiento cardíaco clínicamente significativo.
La ecocardiografía con Doppler color es la herramienta diagnóstica estándar para detectar la IM. La ecocardiografía transtorácica es la herramienta de cribado inicial preferida, pero la ecocardiografía transesofágica es inestimable para definir la gravedad y el mecanismo exacto de la RM aguda, especialmente cuando la sospecha de rotura del músculo papilar es alta. Debe realizarse un cateterismo cardíaco en todos los pacientes para determinar la extensión y la gravedad de la enfermedad arterial coronaria.
Tratamiento de la IM
La determinación de la estabilidad hemodinámica, la elucidación del mecanismo exacto de la IM aguda y el tratamiento oportuno son necesarios para un resultado favorable. El tratamiento médico incluye la reducción de la poscarga con el uso de diuréticos, nitroprusiato de sodio y nitratos en los pacientes que no están hipotensos.
En los pacientes que tienen un compromiso hemodinámico, debe aplicarse rápidamente la contrapulsación con balón intraaórtico. Esta intervención suele reducir sustancialmente la poscarga y el volumen regurgitante, mejorando el gasto cardíaco en preparación para la reparación quirúrgica. Sin la reparación quirúrgica, el tratamiento médico por sí solo en pacientes con rotura del músculo papilar da lugar a una mejora hemodinámica inadecuada y a un mal pronóstico a corto plazo.
La intervención quirúrgica de urgencia es el tratamiento de elección para la rotura del músculo papilar. Los enfoques quirúrgicos pueden incluir la reparación o la sustitución de la válvula mitral. En ausencia de necrosis del músculo papilar, la reparación de la válvula mitral mejora la tasa de supervivencia más que la sustitución de la válvula mitral. Esta diferencia se debe a que el aparato subvalvular suele conservarse. La reparación de la válvula mitral también elimina las complicaciones relacionadas con el mal funcionamiento de la prótesis.
En pacientes con necrosis extensa del músculo papilar y/o de la pared libre del ventrículo, la sustitución de la válvula mitral es la modalidad preferida. En un estudio se demostró que el injerto de derivación de la arteria coronaria (CABG) realizado en el momento de la cirugía mejora la supervivencia a corto y largo plazo.
La única situación en la que se puede evitar con seguridad la cirugía de urgencia es en el caso de la IM intermitente debida a la isquemia recurrente. En estos pacientes, la revascularización miocárdica exitosa puede ser eficaz. Este procedimiento se lleva a cabo mediante angioplastia o injerto de derivación de la arteria coronaria.
OVNI dinámica
Originalmente se pensaba que sólo estaba presente en la miocardiopatía hipertrófica, varios investigadores han informado de la presencia de OVNI dinámica como complicación del IM anterior agudo. También se ha postulado que la presencia de LVOTO dinámica es una de las etiologías de la rotura miocárdica.
La OVTL dinámica está causada mecánicamente por una hipercinesia compensatoria de los segmentos basal y medio del VI en pacientes con infartos distales de la ADA. Los predictores de un mayor movimiento regional de la pared en las zonas no infartadas son la ausencia de enfermedad multivaso, el sexo femenino y un mayor flujo en el vaso relacionado con el infarto. El aumento de la fuerza contráctil del miocardio basal provoca regurgitación mitral a través del efecto Venturi. Esto da lugar a un aumento de la OTO, lo que conduce a una mayor reducción del gasto del VI en el contexto de una hipoperfusión sistémica ya presente.
Este aumento de la OTO del VI en el contexto de un miocardio transmural dañado forma un escenario perfecto en el que hay un aumento de la presión intraventricular de fin de sístole, que induce un aumento de la tensión de la pared de la zona del infarto debilitada y necrótica. Esta complicación, con frecuencia mortal, se produce con mayor frecuencia en mujeres, pacientes de edad avanzada (>70 años) y aquellos sin un IM previo.
Presentación clínica de la OVTL
Los pacientes afectados pueden presentar los síntomas habituales de un complejo de síntomas autonómicos exacerbados, como dificultad respiratoria, diaforesis y extremidades frías y húmedas, además de los signos y síntomas típicos del IAM.
Estos pacientes pueden evolucionar rápidamente a un shock cardiogénico con ortopnea grave, disnea y oliguria, y pueden tener un estado mental alterado por hipoperfusión cerebral. Los pacientes pueden presentar un nuevo soplo sistólico de eyección, un nuevo soplo holosistólico que se irradia a la axila como resultado del movimiento sistólico anterior (SAM) de la valva mitral. También pueden estar presentes un galope S3, estertores pulmonares, hipotensión y taquicardia; estos últimos signos físicos pueden estar totalmente ausentes en la situación aguda.
La ecocardiografía transtorácica o transesofágica (ETT/ETE) es la prueba diagnóstica de elección y puede caracterizar con precisión el segmento hipercinético, la OVL y la SAM de la valva mitral.
Tratamiento de la OVL
Considere la posibilidad de reducir la hipercontractilidad del miocardio mediante la adición cuidadosa de betabloqueo. También la reanimación lenta del volumen mediante el aumento de la poscarga (fenileferina) puede aumentar la precarga y disminuir la LVOTO y la SAM. Lo mejor sería evitar los medicamentos que aumentan la poscarga. También deben evitarse los vasodilatadores, los inótropos y los balones de contrapulsación, ya que pueden aumentar la OVTL.
Fallo del VD
La disfunción leve del VD tras un IM es frecuente; sin embargo, en la mayoría de los casos el efecto sobre el VI es mínimo.
La hipocinesia significativa del VD se produce cuando hay una oclusión proximal de la arteria coronaria derecha con pocas colaterales de la circulación del lado izquierdo. Se postula que, debido a que el VD tiene paredes delgadas y una menor demanda de oxígeno, hay perfusión coronaria durante todo el ciclo cardíaco; por lo tanto, el infarto irreversible generalizado es raro.
La insuficiencia típica del VD puede presentarse con hipotensión (debido a la falta de precarga del VI) y distensión venosa yugular con un campo pulmonar despejado. Aunque se describe clásicamente en el contexto de la insuficiencia del VD, esta tríada rara vez se observa en su forma pura en el ámbito clínico. La mayoría de los pacientes presentan un shock cardiogénico de bajo rendimiento o una insuficiencia del VI con síntomas autonómicos asociados.
La presencia de una presión venosa yugular superior a 8 cm H2O y el signo de Kussmaul son altamente sensibles y específicos para la insuficiencia del VD grave.
Ocasionalmente, la derivación de derecha a izquierda a través de un foramen oval permeable causa hipoxemia persistente. Tenga en cuenta esta peculiar complicación.
Electrocardiográficamente, los pacientes se presentan con elevación inferior del ST junto con elevación del ST en la derivación V4R. La radiografía de tórax suele ser anodina, sin distensión venosa del lóbulo superior.
Diagnóstico de la insuficiencia del VD
La ecocardiografía bidimensional (2D) y la resonancia magnética (RM) son muy útiles. La mayoría de las veces, la ecocardiografía ayudará a afianzar el diagnóstico.
Los hallazgos del cateterismo de Swan-Ganz suelen sugerir presiones elevadas en la AR con una PCWP baja.
Tratamiento de la insuficiencia del VD
La reanimación del volumen para mantener la PCWP en o alrededor de 15 mmHg podría ayudar a temporizar aumentando transitoriamente la precarga del VD. Aunque el tratamiento definitivo pasa por restablecer la circulación coronaria. En casos poco frecuentes de insuficiencia del VD grave, debe considerarse la posibilidad de un soporte circulatorio mecánico mediante dispositivos de asistencia del VD (DA), ya sea temporalmente o como terapia puente en el contexto de una amplia afectación biventricular.