La mayoría de los tratamientos médicos están diseñados para el «paciente medio» como un enfoque único, que puede tener éxito para algunos pacientes pero no para otros. La medicina de precisión, a veces conocida como «medicina personalizada», es un enfoque innovador para adaptar la prevención y el tratamiento de las enfermedades que tiene en cuenta las diferencias en los genes, el entorno y el estilo de vida de las personas. El objetivo de la medicina de precisión es dirigir los tratamientos adecuados a los pacientes adecuados en el momento oportuno.
Los avances en la medicina de precisión ya han dado lugar a nuevos y potentes descubrimientos y a tratamientos aprobados por la FDA que se adaptan a las características específicas de los individuos, como la composición genética de una persona o el perfil genético del tumor de un individuo. Los pacientes con diversos tipos de cáncer se someten habitualmente a pruebas moleculares como parte de la atención al paciente, lo que permite a los médicos seleccionar tratamientos que mejoren las posibilidades de supervivencia y reduzcan la exposición a los efectos adversos.
- Pruebas de secuenciación de próxima generación (NGS)
- El papel de la FDA en el avance de la medicina de precisión
- Agilización de la supervisión reglamentaria de la FDA de las pruebas NGS
- Guía sobre bases de datos clínicas
- Guía de validación analítica
- Plataforma bioinformática de la FDA
- ¿Preguntas?
- Lo que dicen los funcionarios de la FDA
- Guías finales de la NGS
- Informes y documentos de debate
- Reuniones anteriores
Pruebas de secuenciación de próxima generación (NGS)
La atención de precisión sólo será tan buena como las pruebas que guíen el diagnóstico y el tratamiento. Las pruebas de secuenciación de próxima generación (NGS) son capaces de identificar o «secuenciar» rápidamente grandes secciones del genoma de una persona y constituyen importantes avances en las aplicaciones clínicas de la medicina de precisión.
Los pacientes, los médicos y los investigadores pueden utilizar estas pruebas para encontrar variantes genéticas que les ayuden a diagnosticar, tratar y comprender mejor las enfermedades humanas.
El papel de la FDA en el avance de la medicina de precisión
La FDA está trabajando para garantizar la precisión de las pruebas de NGS, de modo que los pacientes y los médicos puedan recibir resultados de pruebas precisos y clínicamente significativos.
La gran cantidad de información generada a través de la NGS plantea nuevos problemas de regulación para la FDA. Mientras que los enfoques normativos actuales son apropiados para los diagnósticos convencionales que detectan una sola enfermedad o condición (como los niveles de glucosa o colesterol en sangre), estas nuevas técnicas de secuenciación contienen el equivalente a millones de pruebas en una sola. Por ello, la FDA ha colaborado con las partes interesadas de la industria, los laboratorios, el mundo académico y las sociedades de pacientes y profesionales para desarrollar un enfoque normativo flexible que dé cabida a esta tecnología en rápida evolución y que aproveche las normas consensuadas, los datos de origen colectivo y la tecnología informática de código abierto de última generación para apoyar el desarrollo de pruebas de NGS. Este enfoque permitirá la innovación en las pruebas y la investigación, y acelerará el acceso a pruebas genéticas precisas y fiables.
Agilización de la supervisión reglamentaria de la FDA de las pruebas NGS
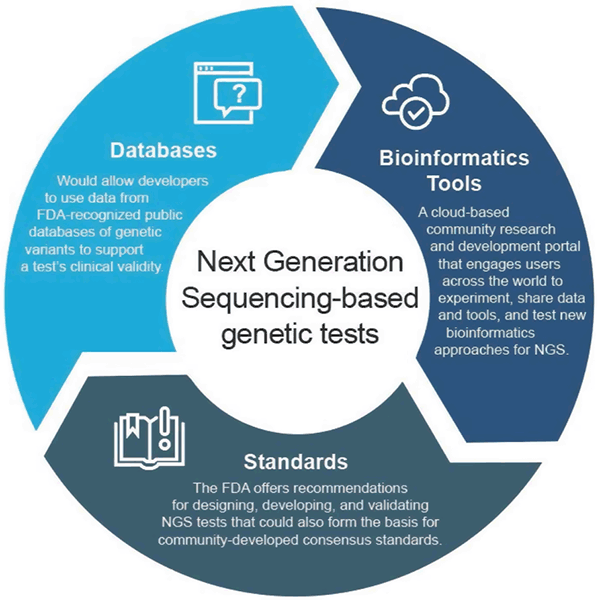
En abril de 2018, la FDA publicó dos directrices finales que recomiendan enfoques para agilizar la presentación y la revisión de los datos que respaldan la validez clínica y analítica de las pruebas basadas en NGS. Estas recomendaciones pretenden proporcionar un enfoque de supervisión reglamentaria eficiente y flexible: a medida que la tecnología avanza, las normas pueden evolucionar rápidamente y utilizarse para establecer métricas adecuadas para campos de rápido crecimiento como la NGS. Del mismo modo, a medida que mejoren las pruebas clínicas, se podrían respaldar nuevas afirmaciones. Este enfoque adaptativo fomentaría, en última instancia, la innovación entre los desarrolladores de pruebas y mejoraría el acceso de los pacientes a estas nuevas tecnologías.
Guía sobre bases de datos clínicas
La guía final «Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics» (Uso de bases de datos públicas de variantes genéticas para respaldar la validez clínica de una prueba) permite a los desarrolladores utilizar datos de bases de datos genéticas públicas reconocidas por la FDA para ayudar a respaldar la validez clínica de una prueba y describe cómo los administradores de bases de datos pueden solicitar el reconocimiento de sus bases de datos si cumplen ciertas recomendaciones de calidad. Este enfoque incentiva el intercambio de datos y proporciona un camino más eficiente hacia el mercado.
Más información sobre el reconocimiento de bases de datos está disponible en la página web de la FDA Recognition of Public Human Genetic Variants Databases.
Guía de validación analítica
La guía final «Considerations for Design, Desarrollo, and Analytical Validation of Next Generation Sequencing (NGS) – Based In Vitro Diagnostics (IVDs) Intended to Aid in the Diagnosis of Suspected Germline Diseases» (Consideraciones para el diseño, el desarrollo y la validación analítica de las pruebas de secuenciación de próxima generación (NGS) basadas en el diagnóstico in vitro (IVD) destinadas a ayudar en el diagnóstico de enfermedades de la línea germinal sospechosas) ofrece recomendaciones para el diseño, el desarrollo y la validación de las pruebas NGS. La guía también alienta la participación de la comunidad en el desarrollo de normas relacionadas con la NGS por parte de las organizaciones de desarrollo de normas (SDO), ya que las normas pueden evolucionar más rápidamente con los cambios en la tecnología y el conocimiento y, por lo tanto, pueden utilizarse para establecer métricas adecuadas, como los umbrales de rendimiento específicos para los campos de rápido crecimiento como la NGS.
Plataforma bioinformática de la FDA
La FDA creó precisionFDA, un portal de investigación y desarrollo comunitario basado en la nube que involucra a usuarios de todo el mundo para compartir datos y herramientas con el fin de probar, pilotar y validar enfoques bioinformáticos existentes y nuevos para el procesamiento de NGS. Las personas y organizaciones de la comunidad genómica pueden encontrar más información y registrarse para participar en http://precision.fda.gov.
¿Preguntas?
Por favor, póngase en contacto con nosotros si tiene alguna pregunta sobre los esfuerzos de la FDA en materia de medicina de precisión en [email protected].
Lo que dicen los funcionarios de la FDA
- La FDA finaliza las directrices para acelerar el desarrollo de pruebas fiables, pruebas beneficiosas basadas en la secuenciación de próxima generación
Guías finales de la NGS
- Uso de bases de datos públicas de variantes genéticas humanas para respaldar la validez clínica de los diagnósticos in vitro genéticos y basados en la genómica – Guía para las partes interesadas y el personal de la Administración de Alimentos y Medicamentos (PDF – 444KB)
- Consideraciones para el diseño, Development, y la validación analítica de los diagnósticos in vitro basados en la secuenciación de próxima generación (NGS) destinados a ayudar en el diagnóstico de presuntas enfermedades de la línea germinal: Guía para las partes interesadas y el personal de la Administración de Alimentos y Medicamentos (PDF – 869KB)
Informes y documentos de debate
- Optimización de la supervisión reglamentaria de la FDA de las pruebas de diagnóstico de secuenciación de nueva generación (PDF – 424KB)
- Informe: Paving the Way for Personalized Medicine (Archived)
Reuniones anteriores
- 07/27/16: Webinar – Next Generation Sequencing (NGS) Draft Guidances: Implicaciones para pacientes y proveedores
- 07/27/16: Webinar – Borrador de las Guías de Secuenciación de Próxima Generación (NGS): Aspectos técnicos y normativos
- 11/13/2015: Taller público – Uso de bases de datos para establecer la relevancia clínica de las variantes genéticas humanas
- 11/12/2015: Enfoque basado en estándares para la evaluación del rendimiento analítico de las pruebas de diagnóstico in vitro de secuenciación de próxima generación
- 02/20/2015: Optimización de la supervisión reglamentaria de la FDA de las pruebas de diagnóstico de secuenciación de próxima generación Taller público