Propiedades físicas de los compuestos iónicos frente a los covalentes
En general, los compuestos iónicos y covalentes tienen propiedades físicas diferentes. Los compuestos iónicos forman sólidos cristalinos duros que se funden a altas temperaturas y son resistentes a la evaporación. Estas propiedades se derivan de la estructura interna característica de un sólido iónico, ilustrada de forma esquemática en la parte (a) de la figura 2.7.4, que muestra el conjunto tridimensional de iones positivos y negativos alternados que se mantienen unidos por fuertes atracciones electrostáticas. Por el contrario, como se muestra en la parte (b) de la figura 9.5.1, la mayoría de los compuestos covalentes están formados por moléculas discretas que se mantienen unidas por fuerzas intermoleculares comparativamente débiles (las fuerzas entre las moléculas), aunque los átomos de cada molécula se mantienen unidos por fuertes enlaces covalentes intramoleculares (las fuerzas dentro de la molécula). Las sustancias covalentes pueden ser gases, líquidos o sólidos a temperatura y presión ambiente, dependiendo de la fuerza de las interacciones intermoleculares. Los sólidos moleculares covalentes tienden a formar cristales blandos que se funden a bajas temperaturas y se evaporan fácilmente.
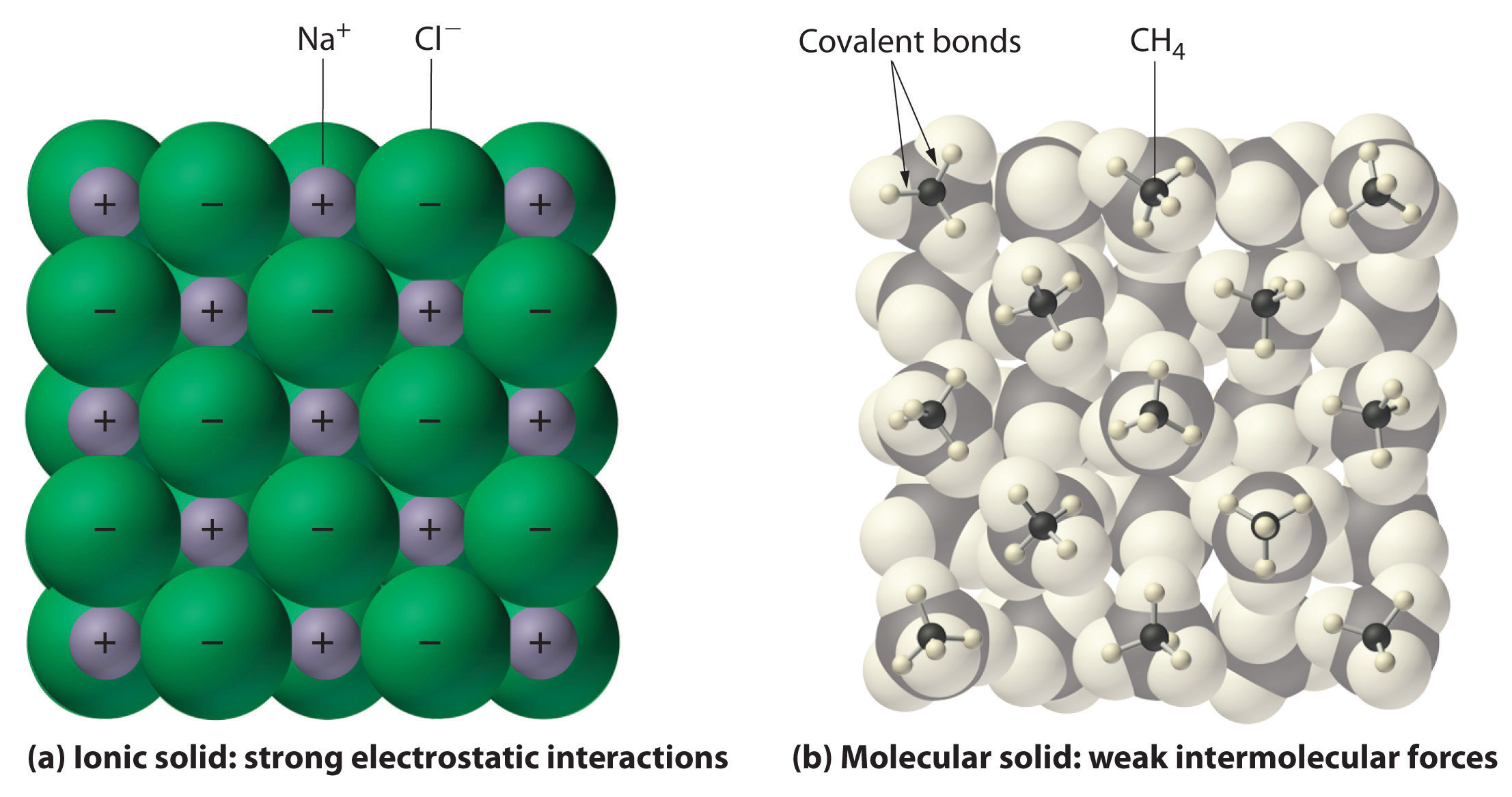
Figura 9.5.1: Interacciones en los sólidos iónicos y covalentes. (a) Los iones cargados positiva y negativamente en un sólido iónico como el cloruro de sodio (NaCl) se mantienen unidos por fuertes interacciones electrostáticas. (b) En esta representación del empaquetamiento de moléculas de metano (\(CH_4\)) en el metano sólido, un sólido molecular prototípico, las moléculas de metano se mantienen unidas en el sólido sólo por fuerzas intermoleculares relativamente débiles, aunque los átomos dentro de cada molécula de metano se mantienen unidos por fuertes enlaces covalentes.
Hidrocarburos
Los sólidos moleculares están formados por átomos o moléculas que se mantienen unidos por interacciones dipolo-dipolo, fuerzas de dispersión de Londres o enlaces de hidrógeno, o cualquier combinación de ellas. La disposición de las moléculas en el benceno sólido es la siguiente:

Figura 9.5.2: La estructura del benceno sólido. En el benceno sólido, las moléculas no están dispuestas con sus planos paralelos entre sí, sino en ángulos de 90°.
Debido a que las interacciones intermoleculares en un sólido molecular son relativamente débiles en comparación con los enlaces iónicos y covalentes, los sólidos moleculares tienden a ser blandos, de baja fusión y fácilmente vaporizables (\(ΔH_{fus}\) y \(ΔH_{vap}\) son bajos). Para sustancias similares, la fuerza de dispersión de London aumenta suavemente con el aumento de la masa molecular. Por ejemplo, los puntos de fusión del benceno (C6H6), el naftaleno (C10H8) y el antraceno (C14H10), con uno, dos y tres anillos aromáticos fusionados, son de 5,5°C, 80,2°C y 215°C, respectivamente. Las entalpías de fusión también aumentan suavemente dentro de la serie: benceno (9,95 kJ/mol) < naftaleno (19,1 kJ/mol) < antraceno (28,8 kJ/mol). Sin embargo, si las moléculas tienen formas que no pueden empaquetarse eficazmente en el cristal, los puntos de fusión y las entalpías de fusión tienden a ser inesperadamente bajos porque las moléculas no pueden organizarse para optimizar las interacciones intermoleculares. Así, el tolueno (C6H5CH3) y el m-xileno tienen puntos de fusión de -95°C y -48°C, respectivamente, que son significativamente más bajos que el punto de fusión del análogo más ligero pero más simétrico, el benceno.
El caucho autorregenerable es un ejemplo de sólido molecular con potencial para importantes aplicaciones comerciales. El material puede estirarse, pero cuando se rompe en pedazos puede volver a unirse mediante el restablecimiento de su red de enlaces de hidrógeno sin mostrar ningún signo de debilidad. Entre otras aplicaciones, se está estudiando su uso en adhesivos y neumáticos de bicicleta que se autocurecen.

Figura 9.5.3: Tolueno y m-xileno. Los grupos metilo unidos al anillo de fenilo en el tolueno y el m-xileno impiden que los anillos se empaqueten tan bien como en el benceno sólido.