24-6C Reacciones de los compuestos nitro
Los compuestos nitro son bastante inestables en el sentido termodinámico; por ejemplo, el calor de descomposición del nitrometano, según la siguiente estequiometría, es (67.4 \text{kcal mol}^{-1}}).
Se aprovechan las energías considerables y las velocidades rápidas de reacciones como ésta en el uso comercial de los compuestos nitro como explosivos. En el caso de algunos compuestos nitro, como el TNT, existe la ventaja adicional de la baja sensibilidad al choque.
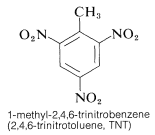
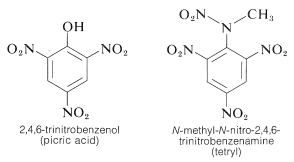
El TNT no se detona fácilmente por simple impacto e incluso arde sin explotar. Sin embargo, una vez iniciada la detonación, la descomposición se propaga rápidamente. Las características de estabilidad razonable en la manipulación y el alto potencial termodinámico hacen que los compuestos nitro sean especialmente útiles. Otros polinitrocompuestos útiles como explosivos son el PETN (Sección 17-3C), la ciclonita (Sección 16-4C), el ácido pícrico y el tetril:
Una característica importante de los polinitrocompuestos aromáticos es su capacidad para formar complejos de «transferencia de carga» con hidrocarburos aromáticos, especialmente aquellos que están sustituidos con grupos alquilo. Los complejos de 2,4,6-trinitrobencenol (ácido pícrico) y los hidrocarburos aromáticos suelen ser sólidos cristalinos, útiles para la separación, purificación e identificación de los hidrocarburos aromáticos. Estas sustancias se denominan «picratos de hidrocarburos», pero el nombre es engañoso porque no son realmente sales. Además, se forman complejos similares entre hidrocarburos aromáticos y trinitrobenceno, lo que demuestra que los grupos nitro y no el grupo hidroxilo son esenciales para la formación del complejo. La unión en estos complejos se asemeja a la de los complejos \(\pi\) de halógenos con alquenos y benceno (Secciones 22-4D y 10-3C) y resulta de fuerzas atractivas entre sustancias ricas en electrones y pobres en electrones. El nombre descriptivo -complejo de transferencia de carga- sugiere que el complejo tiene estructuras VB que implican la transferencia de un electrón desde la molécula donante (rica en electrones) a la molécula receptora (pobre en electrones). El nombre de complejo \(\pi\) también se utiliza porque, normalmente, al menos uno de los componentes del complejo tiene un sistema \(\pi\)-electrónico. Los complejos de transferencia de carga o \(\pi\) entre los polinitrocompuestos y los hidrocarburos aromáticos parecen dar estructuras de tipo sándwich con los anillos aromáticos en planos paralelos, aunque no necesariamente centrados exactamente uno sobre otro:
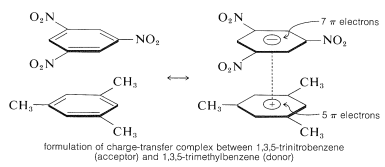
Los complejos de transferencia de carga son casi siempre más coloreados que sus componentes individuales. Un ejemplo espectacular es el benceno y el tetracianoeteno, cada uno de los cuales por separado es incoloro, pero que dan un complejo de color naranja brillante cuando se mezclan. En los complejos de transferencia de carga es de esperar un desplazamiento hacia longitudes de onda más largas, en relación con sus componentes, debido a la mayor posibilidad de estabilización del estado excitado a través de la deslocalización de electrones que implica a ambos componentes.
La reducción de los compuestos nitro ocurre fácilmente con una variedad de agentes reductores y tales reducciones permiten una síntesis particularmente útil de aminas aromáticas (Sección 23-12B):
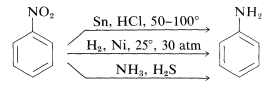
La reducción de un compuesto nitro a una amina requiere seis equivalentes de agente reductor:
No se esperaría que tal reducción ocurriera en un solo paso. De hecho, la reducción es escalonada y procede a través de una cadena de intermedios que, con agentes reductores fuertes en solución ácida, tienen como mucho una existencia transitoria. Los productos intermedios formados sucesivamente a partir de \(\ce{RNO_2}) por incrementos de dos equivalentes de agente reductor son los compuestos nitrosos, \ce{R-N=O}, y los azanoles \(\ce{N})-sustituidos (hidroxilaminas), \(|RNHOH):
{{longrightarrow}} |RN=O} \N – 2 \N – izquierda. \ce{RNHOH} \underset{-\ce{H_2O}}{\overset{2 \left}{\longrightarrow}} \ce{RNH_2}]
Así, los azanoles sustituidos por alilo pueden obtenerse directamente a partir de los correspondientes nitrocompuestos con zinc y solución de cloruro de amonio. Sin embargo, con zinc y ácido clorhídrico se obtiene la amina:
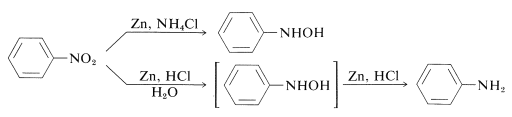
La diferencia entre estas reacciones está en las velocidades de reducción asociadas a la acidez de la solución. El cloruro de amonio es un ácido mucho más débil que el cloruro de amonio; el pH de las soluciones de cloruro de amonio es de alrededor de 6.
La oxidación de los larazanoles en condiciones controladas produce compuestos nitrosos. Esta reacción no es diferente de la oxidación de alcoholes a cetonas (Sección 15-6B):
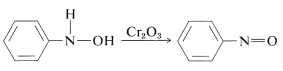
La reducción de los nitrocompuestos de arilo con agentes reductores menos potentes, especialmente en medios alcalinos, da lo que puede parecer un misterioso conglomerado de productos de reducción bimolecular. Por ejemplo, con el nitrobenceno,
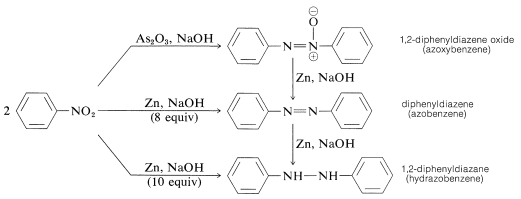
Todas estas sustancias pueden reducirse a benceno con estaño y ácido clorhídrico. Como resultado, cada una podría ser, pero no necesariamente es, un intermedio en la reducción de compuestos nitro a aminas. La formación de los productos de reducción bimolecular es el resultado de reacciones inducidas por bases entre los compuestos nitrosos y los azanoles o las aminas y, posiblemente, de la reducción posterior de las sustancias producidas inicialmente.
Varios derivados del polinitrobenceno tienen importantes usos herbicidas. Algunos ejemplos son la \ce{N}^3\), \ce{N}^3\)-dietil-6-trifluorometil-2,4-dinitro-1,3-bencenamina y la \ce{N}, \ce{N})-dipropil-4-trifluorometil-2,6-dinitrobencenamina:
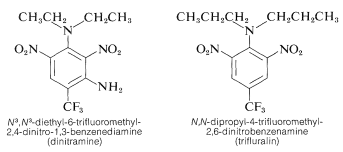
Estas sustancias, cuando se mezclan con el suelo, matan las plántulas de malas hierbas pero no las plantas de cultivo como el algodón, la soja y el cacahuete. La actividad es alta; normalmente sólo se requiere alrededor de \ (0,08 \: \text{g m}^{-2}\) para un buen control de las malas hierbas.
Las reacciones más importantes de los nitroalcanos son las que implican a los \ (\pha\) hidrógenos de los compuestos primarios y secundarios. Por ejemplo, el nitrometano es suficientemente ácido para disolverse en soluciones acuosas de hidróxido. El anión así producido tiene una estructura electrónica análoga a la del anión nitrato:
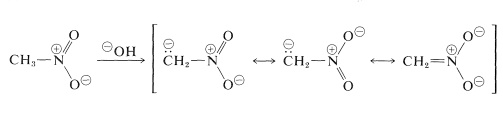
Una propiedad interesante de este ion es que cuando se acidifican las soluciones del mismo, se produce un isómero inestable y bastante fuertemente ácido del nitrometano (llamado forma aci), que revierte lentamente a la forma nitro más estable:
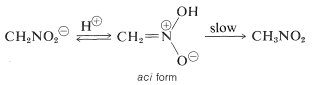
Cambios similares tienen lugar en la acidificación de la sal de enol de un compuesto de carbonilo, siendo la principal diferencia la vida mucho más larga del compuesto aci-nitro comparada con la de un enol de una cetona simple (ver Sección 17-1B).
Los compuestos nitro primarios y secundarios sufren adiciones aldólicas y adiciones Michael con compuestos carbonílicos adecuados y catalizadores básicos:
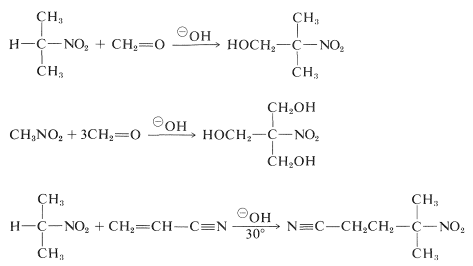
Desgraciadamente, las reacciones de alquilación análogas a la alquilación catalizada por bases de compuestos carbonílicos no suelen ser útiles para la síntesis de nitrocompuestos superiores, ya que la alquilación \ce{C} de las bases conjugadas de los nitrocompuestos primarios es más lenta que la alquilación \ce{O}.