Objetivos de aprendizaje
- Definir y dar ejemplos de los principales tipos de radiactividad.
Los átomos están compuestos por partículas subatómicas-protones, neutrones y electrones. Los protones y los neutrones se encuentran en el núcleo y aportan la mayor parte de la masa del átomo, mientras que los electrones rodean el núcleo en cáscaras y subcáscaras y explican el tamaño del átomo. Recuerde, la notación para representar sucintamente un isótopo de un átomo concreto:
\N-7546>
El elemento de este ejemplo, representado por el símbolo C, es el carbono. Su número atómico, 6, es el subíndice inferior izquierdo del símbolo y es el número de protones del átomo. El número másico, el superíndice de la parte superior izquierda del símbolo, es la suma del número de protones y neutrones en el núcleo de este isótopo concreto. En este caso, el número másico es 12, lo que significa que el número de neutrones en el átomo es 12 – 6 = 6 (es decir, el número másico del átomo menos el número de protones en el núcleo es igual al número de neutrones). A veces se omite el número atómico en esta notación porque el propio símbolo del elemento transmite su número atómico característico. Los dos isótopos del hidrógeno, el 2H y el 3H, reciben sus propios nombres: deuterio (D) y tritio (T), respectivamente. Otra forma de expresar un isótopo concreto es indicar el número de masa después del nombre del elemento, como carbono-12 o hidrógeno-3.
La teoría atómica del siglo XIX suponía que los núcleos tenían composiciones fijas. Pero en 1896, el científico francés Henri Becquerel descubrió que un compuesto de uranio colocado cerca de una placa fotográfica producía una imagen en la placa, incluso si el compuesto estaba envuelto en una tela negra. Pensó que el compuesto de uranio emitía algún tipo de radiación que atravesaba la tela para exponer la placa fotográfica. Investigaciones posteriores demostraron que la radiación era una combinación de partículas y rayos electromagnéticos, cuya fuente última era el núcleo atómico. Estas emanaciones se llamaron finalmente, en conjunto, radiactividad.
Hay tres formas principales de emisiones radiactivas. La primera se llama partícula alfa, que se simboliza con la letra griega α. Una partícula alfa está compuesta por dos protones y dos neutrones, por lo que es lo mismo que un núcleo de helio. (A menudo utilizamos \ce{4}_{2}He}\ para representar una partícula alfa). Tiene una carga 2+. Cuando un átomo radiactivo emite una partícula alfa, el número atómico del átomo original disminuye en dos (por la pérdida de dos protones), y su número másico disminuye en cuatro (por la pérdida de cuatro partículas nucleares). Podemos representar la emisión de una partícula alfa con una ecuación química; por ejemplo, la emisión de partículas alfa del uranio-235 es la siguiente:
¿Cómo sabemos que el producto de la reacción es \ce{^{231}_{90}Th}\? Utilizamos la ley de conservación de la materia, que dice que la materia no puede crearse ni destruirse. Esto significa que debemos tener el mismo número de protones y neutrones en ambos lados de la ecuación química. Si nuestro núcleo de uranio pierde 2 protones, quedan 90 protones, lo que identifica al elemento como torio. Además, si perdemos 4 partículas nucleares del original 235, quedan 231. Por lo tanto, utilizamos la sustracción para identificar el isótopo del átomo de torio -en este caso, \ce{^{231}_{90}Th}).
Los químicos suelen utilizar los nombres de isótopo padre e isótopo hijo para representar el átomo original y el producto distinto de la partícula alfa. En el ejemplo anterior, \ce(^{235}_{92}U}) es el isótopo padre, y \ce(^{231}_{90}Th}) es el isótopo hijo. Cuando un elemento se transforma en otro de esta manera, sufre una desintegración radiactiva.
Ejemplo \(\PageIndex{1}\a): Radón-222
Escribe la ecuación nuclear que representa la desintegración radiactiva del radón-222 por emisión de partículas alfa e identifica el isótopo hijo.
Solución
El radón tiene un número atómico de 86, por lo que el isótopo padre se representa como (\ce{^{222}_{86}Rn\). Representamos la partícula alfa como \(\ce{4}_{2}He}\ y utilizamos la resta (222 – 4 = 218 y 86 – 2 = 84) para identificar el isótopo hijo como un isótopo de polonio, \(\mathrm{^{218}_{84}Po}\):
(\ce{{86}^{222}Rn\\\año,_2^4He + \año,_{84}^{218}Po}\año)
Ejercicio \año(\añoIndex{1}): Polonio-209
Escribe la ecuación nuclear que representa la desintegración radiactiva del polonio-209 por emisión de partículas alfa e identifica el isótopo hijo.
Respuesta
(\ce{_{84}^{209}Po\rightarrow \, _2^4He + \, _{82}^{205}Pb}\)
El segundo tipo principal de emisión radiactiva se llama partícula beta, simbolizada por la letra griega β. Una partícula beta es un electrón expulsado del núcleo (no de las capas de electrones alrededor del núcleo) y tiene una carga de 1. También podemos representar una partícula beta como \ce{0_{-1}e}\) o β-. El efecto neto de la emisión de partículas beta en un núcleo es que un neutrón se convierte en un protón. El número de masa global permanece igual, pero como el número de protones aumenta en uno, el número atómico sube en uno. El carbono-14 se desintegra emitiendo una partícula beta:
\N-7546>
De nuevo, la suma de los números atómicos es la misma en ambos lados de la ecuación, al igual que la suma de los números másicos. (Obsérvese que al electrón se le asigna un «número atómico» de 1, igual a su carga.)
El tercer tipo principal de emisión radiactiva no es una partícula, sino una forma muy energética de radiación electromagnética llamada rayos gamma, simbolizada por la letra griega γ. Los rayos gamma en sí mismos no llevan una carga eléctrica global, pero pueden arrancar electrones de los átomos de una muestra de materia y hacerla cargada eléctricamente (por lo que los rayos gamma se denominan radiación ionizante). Por ejemplo, en la desintegración radiactiva del radón-222, se emiten tanto radiación alfa como gamma, teniendo esta última una energía de 8,2 × 10-14 J por núcleo desintegrado:
Esto puede no parecer mucha energía, pero si se desintegrara 1 mol de átomos de radón, la energía de los rayos gamma sería de 49 millones de kJ
Ejemplo (\PageIndex{2}\): Boro-12
Escribe la ecuación nuclear que representa la desintegración radiactiva del boro-12 por emisión de partículas beta e identifica el isótopo hijo. Se emite un rayo gamma simultáneamente con la partícula beta.
Solución
El isótopo padre es \ce(^{12}_{5}B}) mientras que uno de los productos es un electrón, \ce(^{0}_{-1}e}). Para que los números másico y atómico tengan el mismo valor en ambos lados, el número másico del isótopo hijo debe ser 12, y su número atómico debe ser 6. El elemento que tiene un número atómico de 6 es el carbono. Por lo tanto, la ecuación nuclear completa es la siguiente:
El isótopo hijo es \ce{^{12}_6 C}\).
Ejercicio \(\ PageIndex{2}\): Yodo-131
Escribe la ecuación nuclear que representa la desintegración radiactiva del yodo-131 por emisión de partículas beta e identifica el isótopo hijo. Se emite un rayo gamma simultáneamente con la partícula beta.
Responda
\N
Las emisiones alfa, beta y gamma tienen diferentes capacidades para penetrar en la materia. La partícula alfa, relativamente grande, es fácilmente detenida por la materia (aunque puede impartir una cantidad significativa de energía a la materia con la que entra en contacto). Las partículas beta penetran ligeramente en la materia, tal vez unos pocos centímetros como máximo. Los rayos gamma pueden penetrar profundamente en la materia y pueden impartir una gran cantidad de energía en la materia circundante. La tabla (índice de página 1) resume las propiedades de los tres tipos principales de emisiones radiactivas.
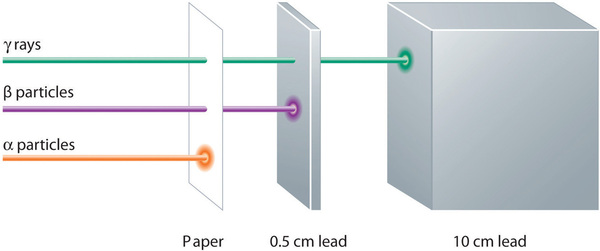
| Partículas Alfa | Partículas Beta | Rayos Gamma | |
|---|---|---|---|
| símbolos | α, \(\mathrm{_{2}^{4}He}\) | β, \(\ce{0}_{-1} e}) | γ |
| identidad | núcleo de helio | electrón | electromagnético |
| carga | 2+ | 1- | nada |
| número de masa | 4 | 0 | 0 |
| poder de penetración | mínimo (no penetra en la piel) | corto (penetra ligeramente en la piel y en algunos tejidos) | profundo (penetra profundamente en los tejidos) |
Ocasionalmente, un núcleo atómico se rompe en trozos más pequeños en un proceso radiactivo llamado fisión espontánea (o fisión). Normalmente, los isótopos hijos producidos por la fisión son una mezcla variada de productos, en lugar de un isótopo específico como ocurre con la emisión de partículas alfa y beta. A menudo, la fisión produce un exceso de neutrones que a veces son capturados por otros núcleos, lo que puede inducir eventos radiactivos adicionales. El uranio 235 sufre una fisión espontánea en pequeña medida. Una reacción típica es
\Nde 7546>
donde \N(\ce{0^1n}\N) es un neutrón. Como en cualquier proceso nuclear, las sumas de los números atómicos y los números de masa deben ser iguales en ambos lados de la ecuación. La fisión espontánea sólo se da en núcleos grandes. El núcleo más pequeño que presenta fisión espontánea es el plomo-208.
La fisión es el proceso radiactivo utilizado en las centrales nucleares y en un tipo de bomba nuclear.
Consigna clave
Los principales tipos de radiactividad son las partículas alfa, las partículas beta y los rayos gamma.
Ejercicio de repaso de conceptos
-
¿Cuáles son los principales tipos de radiactividad? Escribe ecuaciones químicas que demuestren cada tipo.
Respuesta
-
Los principales tipos de radiactividad son la desintegración alfa, la desintegración beta y la emisión de rayos gamma; desintegración alfa con emisión gamma: \(\mathrm{{86}^{222}Rn \rightarrow \, _{84}^{218}Po + \, ^4_2He + \gamma}\); desintegración beta: \(\ce{6^{14}C \rightarrow _7^{14}N + ^0_{-1}e}) (las respuestas variarán)