Si te pregunto qué te viene a la mente en el instante en que escuchas la palabra QUÍMICA, estoy bastante seguro de que te vas a imaginar de pie en un laboratorio de química y sosteniendo diferentes instrumentos de laboratorio. ¿No es así? Pero si observa atentamente el mundo que le rodea, en cualquier momento se producen infinitas reacciones químicas. Por lo tanto, se puede decir con razón que la química forma una gran parte de tu vida cotidiana. La química y las reacciones químicas no se limitan a los laboratorios, sino también al mundo que te rodea. El elemento carbono constituye la unidad básica de los compuestos orgánicos, inorgánicos y organometálicos. Desde el momento en que te vas a dormir hasta que te despiertas, se producen infinitos procesos químicos en cada célula de tu cuerpo. Incluso los procesos ocurren cuando te despiertas, todas tus actividades diarias como beber agua, ducharte, cocinar tu comida, limpiar tu coche, reír o llorar están guiadas por diferentes procesos químicos. Vamos a discutir algunos ejemplos de química que ocurren a nuestro alrededor:
- 1. Composición del cuerpo
- 2. La química de las emociones
- 3. La química en la producción de alimentos
- 4. La química en la higiene
- 5. La química de una cebolla
- 6. La química en la panificación
- 7. La química en los conservantes de los alimentos
- 8. La química en la digestión
- 9. El funcionamiento de un protector solar
- 10. La química en la formación del óxido
1. Composición del cuerpo
Tu cuerpo es un lugar fascinante. El carbono y el oxígeno son los dos elementos más esenciales del cuerpo. Los otros elementos que están presentes en tu cuerpo son el nitrógeno, el fósforo, el hidrógeno, el oxígeno, el calcio, el potasio, el azufre, el magnesio, etc.
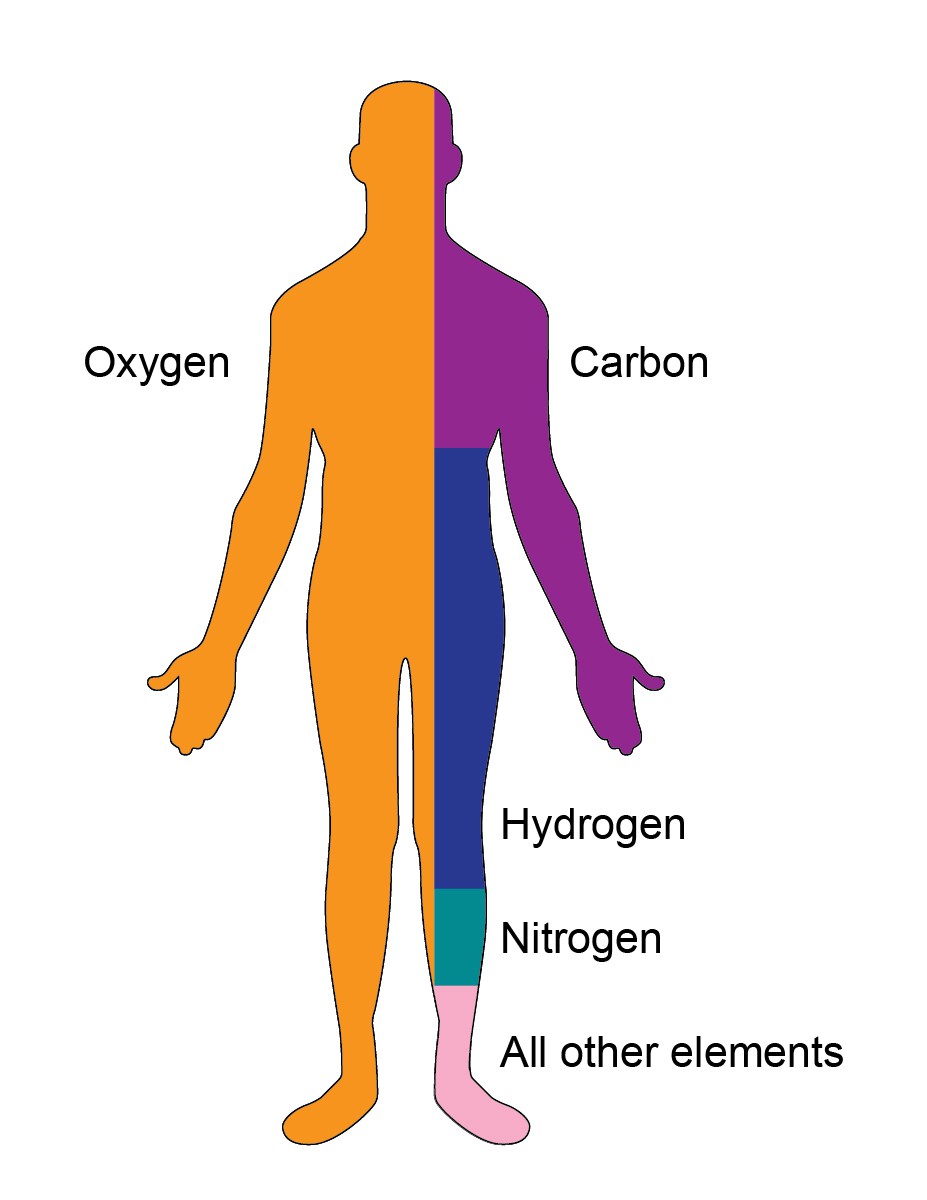
| ELEMENTO | PORCENTAJE EN EL CUERPO | Función |
|---|---|---|
| Oxígeno (O) | 65 | Disolvente primario -Regula la temperatura &la presión osmótica |
| Carbono (C) | 18 | -Fuente de energía -Construcción del cuerpo |
| Hidrógeno (H) | 10 | Presente en el agua y en todas las moléculas orgánicas |
| Nitrógeno (N) | 3 | -Se encuentra en las proteínas y los ácidos nucleicos |
| Calcio (Ca) | 1.5 | Crítica para la contracción muscular |
| Fósforo (P) | 1.0 | -Actúa como amortiguador -Proporciona fuerza y estructura a los huesos y dientes |
| Potasio (K) | 0.35 | -Electrolito crucial -Ayuda a la transmisión del impulso nervioso -Regula los latidos del corazón |
| Azufre (S) | 0.25 | Da forma a las proteínas que ayudan al buen funcionamiento de las mismas |
| Sodio (Na) | 0.15 | Importante electrolito para regular la cantidad de agua -Ayuda a la señalización nerviosa |
| Magnesio (Mg) | 0.05 | Requerido en más de 300 reacciones bioquímicas -Construye músculos y huesos -Cofactor principal en muchas reacciones enzimáticas |
| Hierro (Fe) | 0.006 | Ayuda a la producción de sangre |
| Cobre (Cu), Zinc (Zn), Selenio (Se), Molibdeno (Mb), Fluoro (F), Yodo (I), Manganeso (Mn), Cobalto (Co) |
Total es inferior a 0.70 | El cobre es un micronutriente para el crecimiento y el desarrollo, y también es esencial para diversas funciones metabólicas El zinc desempeña un papel importante en el crecimiento celular, la división celular, la curación de heridas y la descomposición de los hidratos de carbono -El selenio protege al organismo del daño oxidativo -El molibdeno elimina las toxinas del metabolismo de los aminoácidos que contienen azufre -El flúor es responsable de la mineralización y la formación del esmalte dental -El yodo es esencial para la formación de las hormonas tiroideas -El manganeso contribuye a la formación de los tejidos conectivos, los huesos, los factores de coagulación de la sangre, las hormonas sexuales, además de ser fundamental en el metabolismo de las grasas y los hidratos de carbono, la absorción del calcio y la regulación del azúcar en la sangre |
| Litio (Li), Estroncio (Sr), Aluminio (Al), Silicio (Si), Plomo (Pb), Arsénico (As), Vanadio (V), Bromo (Br) |
Presentes en cantidades traza | El litio es esencial para el mantenimiento de la salud neurológica -El estroncio ayuda a la formación de los huesos y previene su pérdida; la forma radiactiva del estroncio también puede matar algunas células cancerosas -El aluminio es responsable de la compactación de la cromatina -El silicio ayuda a promover la firmeza y la fuerza en las arterias, los tejidos conectivos, los tendones, la piel y los ojos -El vanadio desempeña un papel en la metabolización de las enzimas |
2. La química de las emociones

Cuando te sientes feliz, triste, extasiado, relajado o estresado, se producen muchas reacciones químicas en tu cuerpo. Es debido a los mensajeros químicos llamados neurotransmisores liberados en el cerebro que puedes enamorarte y llorar ríos a causa del desamor. 
3. La química en la producción de alimentos
Las plantas producen alimentos para sí mismas a través de la fotosíntesis; que es una reacción química compleja en sí misma. La reacción química que tiene lugar en la fotosíntesis es la reacción química más común y vital. Los animales también liberan energía para realizar sus actividades diarias mediante reacciones químicas respiratorias similares.
6 CO2 + 6 H2O + luz → C 6H12O6 + 6 O2

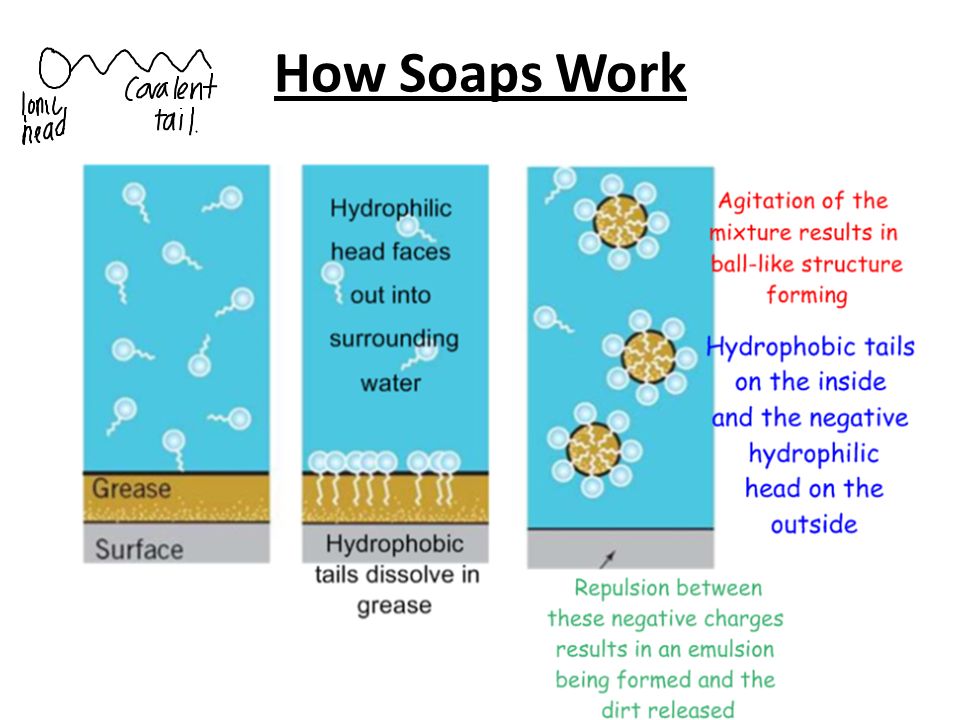
4. La química en la higiene

5. La química de una cebolla


6. La química en la panificación


7. La química en los conservantes de los alimentos


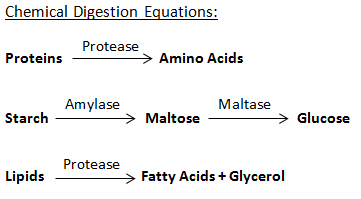
8. La química en la digestión

9. El funcionamiento de un protector solar


10. La química en la formación del óxido
Fe + O2 + H2O → Fe2O3. XH2O